微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向200 mL 0.1mol/L 的Fe(NO3)2溶液中加入一定量NaOH,使Fe2+完全沉淀,加热、蒸干并灼烧混合物直至质量不再变化,此时固体的质量可能为
A.1.60 g
B.2.76 g
C.4.36 g
D.5.54 g
参考答案:CD
本题解析:略
本题难度:一般
2、选择题 某课外研究性化学兴趣小组查阅资料:硫酸铜受热分解生成氧化铜和气体,受热温度不同,该 气体成分也不同,气体成分可能含
气体成分也不同,气体成分可能含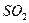 、
、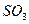 和
和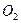 中的一种、两种或三种。下列叙述中错误的是(?)
中的一种、两种或三种。下列叙述中错误的是(?)
A.所得气体成分只有一种,则气体为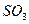
B.所得气体成分有两种,则气体为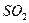 、
、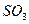
C.所得气体成分有三种,则气体为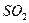 、
、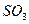 和
和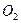
D.若发现气体成分中有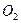 ,则该气体中一定含有
,则该气体中一定含有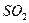
参考答案:B
本题解析:略
本题难度:简单
3、计算题 已知:CuS、Cu2S是两种黑色不溶于水的固体,但一定条件下都能与稀HNO3反应,用离子方程式表示为:
①3CuS+8H++8NO3-=3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-=6Cu2++3SO42-+10NO↑+8H2O
现有不同质量的四份CuS、Cu2S的混合物样品分别和100mL物质的量浓度5mol/L稀硝酸充分反应,所取样品质量与产生气体体积(标准状况下测定)如下表所示:
实验序号
| a
| b
| c
|
样品质量(g)
| 9.6
| 12.8
| 64.0
|
气体体积(L)
| 5.04
| 6.72
| V
|
?
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
(1)a组实验结束后,溶液中c(NO3-)=?;
(2)b组实验结束后,溶液的pH=?;
(3)通过计算分析实验c组中产生气体的体积(V)范围?。
参考答案:(1)2.75mol/L
(2) 0
(3)7L< V <11.2L
本题解析:(1)设9.6g的样品中CuS的物质的量为x,Cu2S的物质的量为y
96x+160y=9.6? 8x/3+10y/3=0.225
解得:x=y=0.0375mol, c(NO3-)= (0.5mol-0.225 mol)/0.4L=2.75mol/L
(亦可根据N原子守恒来求)
(2)设12.8g的样品中CuS的物质的量为x,Cu2S的物质的量为y
96x+160y=12.8
8x/3+10y/3=0.3
解得:x=y=0.05mol
根据方程式①、②可知消耗n(H+)=0.05mol×8/3+0.05mol×16/3=0.4mol
故剩余n(H+)=0.1mol,c(H+)=1mol/L? pH=0
(3)首先判断64g样品中CuS、Cu2S的物质的量皆为0.25mol,分别跟0.5mol硝酸反应时均过量。因此采用极端假设法思考:
若HNO3均与CuS反应:硝酸不足,则V(NO)=0.5mol×22.4L/mol=11.2L
若HNO3均与Cu2S反应:硝酸不足,则V(NO)=0.5mol×10/16×22.4L/mol=7L
所以:c中产生气体体积(V)等于7L< V <11.2L。
本题难度:简单
4、填空题 有关FeSO4的转化关系如下图所示(无关物质已略去)。
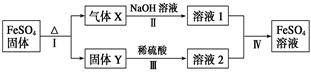
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是_______________(填化学式),写出通入BaCl2溶液,产生白色沉淀的化学方程式______________________________。
(2)反应Ⅰ的反应类型属于________(填序号)。
a.分解反应? b.复分解反应? c.置换反应? d.化合反应?e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是_____________________________
(4)若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅳ中生成FeSO4的离子方程式是_________________
参考答案:(1)SO2、SO3(2分)? SO3+BaCl2+H2O =BaSO4↓+2HCl(3分)
(2)ae(2分)
(3)取少量溶液2于试管中,滴加几滴KSCN溶液,溶液变成血红色,则证明原溶液中含有Fe3+(3分)
(4)2Fe3++SO32-+H2O=2Fe2++SO42-+2H+(3分)
本题解析:
X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。确定成分为SO2、SO3;且产生沉淀的方程式为SO3+BaCl2+H2O =BaSO4↓+2HCl;
反应Ⅰ的反应类型属于分解反应、氧化还原反应;
固体Y中铁为+3,溶液2中检验Fe3+取少量溶液2于试管中,滴加几滴KSCN溶液,溶液变成血红色,则证明原溶液中含有Fe3+;
则反应Ⅳ中生成FeSO4的离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+。
本题难度:一般
5、实验题 硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:
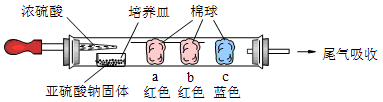
棉球
| 棉球上滴加的试剂
| 实验现象
| 解释和结论
|
a
| ?
?
| 棉球变白,微热后又恢复红色
| 
|
b
| 含酚酞的NaOH溶液
| 棉球变为白色
| 离子方程式:
?
|
c
| ?
?
| 棉球变为白色
| ?
结论:该气体具有??性
|
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验。下图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置。
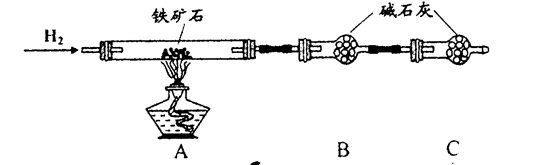
实验一:铁矿石中含氧量的测定
a.按上图组装仪器(夹持仪器均省略),检查装置的气密性;
b.将5.0g铁矿石放入硬质玻璃管中;
c.从左端导气管口处不断地缓缓通入H2,?后,点燃A处酒精灯;
d.充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)步骤c中填空
(2)测得反应后装置B增重1.35g,则铁矿石中氧的质量分数为______________________。实验二:铁矿石中含铁量的测定

(3)步骤④中煮沸的目的是_____________________________________________。
(4)步骤②和⑤中都要用到的玻璃仪器是______?__。
(5)下列有关步骤⑥的操作中说法不正确的是_______________________________。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶不需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成
(6)由实验一、二得出该铁矿石中铁的氧化物的化学式为____________________________。
参考答案:Ⅰ(每空1分)
棉球
棉球上滴加的试剂
实验现象
解释和结论
a
品红试液
?
?
?
b
?
?
离子方程式:
2OHˉ+SO2=SO32ˉ+H2O?
c
含淀粉的碘水
?
?
结论:该气体具有?还原??性
Ⅱ、(1)在C装置出口处收集H2并验纯后。(1分)(2)24%(2分)
(3)除去溶液中溶解的过量的Cl2(1分)(4)烧杯、玻璃棒(1分)(5)c(1分)(6)Fe5O6(2分)
本题解析:Ⅰ.a、浓硫酸与亚硫酸钠反应生成SO2,SO2具有漂白性。品红试液是红色的,二氧化硫能使品红褪色,漂白原理是:SO2与品红反应生成无色不稳定物质,遇热分解又生成SO2和品红,又恢复红色。b、氢氧化钠遇到酚酞也是红色的,SO2是酸性氧化物,能和氢氧化钠反应是溶液碱性降低,导致红色消失,反应原理是:2OHˉ+SO2=SO32ˉ+H2O。c、碘单质遇到淀粉变为蓝色,二氧化硫具有还原性,能将碘单质还原为碘离子,SO2+I2+2H2O=H2SO4+2HI,从而使蓝色消失。
Ⅱ、氢气是可燃性气体,点燃前相应检验其纯度,所以在C装置出口处收集H2并验纯后再点燃A处酒精灯。
(2)该实验中,氢气和氧化铁反应生成金属铁和水,根据固体质量的变化来计算铁的含量,B处的干燥管作用是吸收产生的水蒸气,测的反应后装置B增重1.35g,即反应中生成水的质量是1.35g,物质的量=1.35g÷18g/mol=0.075mol,其中氧元素的质量=0.075mol×16g/mol=1.2g。所以根据氧原子守恒可知,铁矿石中氧的质量分数=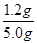 ×100%=24%。
×100%=24%。
(3)氯气具有强氧化性,能氧化碘离子,从而干铁离子与碘离子的反应,所以煮沸的作用是赶走溶液中溶解的过量的Cl2。
(4)②是过滤,需要烧杯、玻璃棒和铁架台。⑤是物质的量浓度的配制,需要的仪器是250ml容量瓶、烧杯、玻璃棒、胶头滴管,所以步骤②和⑤中都要用到的玻璃仪器是烧杯和玻璃棒。
(5)a.滴定管用蒸馏水洗涤后必须用标准液润洗,因此a正确;b.锥形瓶不需要用待测液润洗,b正确;c.因为碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,c不正确,答案选c。(6)由于所取溶液(含Fe3+)的体积与消耗KI溶液的体积相等,结合方程式2Fe3++2I-=I2+2Fe2+可知,c(Fe3+)=c(KI)=0.5mol?L-1,所以铁元素的物质的量=0.5mol/L×0.25L=0.125mol,所以氧化物中铁与氧的个数之比=0.125mol:0.075mol×2=6:5,因此化学式为Fe5O6。2的性质、铁矿石中元素含量测定的实验设计与探究以及化学式确定的有关计算
本题难度:一般