微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A原子的电子式为
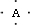
,B原子L层的电子总数是K层的3倍;0.1mol?C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
(1)元素A、B、C、D分别是:A______,B______,C______,D______.
(2)D元素在周期表中属第______周期______族.
(3)用电子式表示A的气态氢化物的形成过程:______.
(4)A和B的单质充分反应生成化合物的电子式是______.
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明______;______.
参考答案:答案:(1)B原子L层的电子总数是K层的3倍,则B的原子原子核外各层电子数分别为2、6,应为O元素,根据A的电子式可知A的最外层有4个电子,应为周期表第ⅣA族元素,又原子序数小于O,应为C元素,0.1mol?C单质能从酸中置换出2.24L氢气(标准状况),则C的最外层有2个电子,离子的与氖原子的电子层结构相同,则C为Mg元素,D离子的半径比C离子的小,D离子与B离子的电子层结构相同,D应为Al元素,故答案为:碳,氧,镁,铝;
(2)D为Al元素,原子序数为13,原子核外有3个电子层,最外层电子数为3,位于周期表第三周期ⅢA族,
故答案为:三,ⅢA;
(3)A的气态氢化物为CH4,用电子式表示形成过程为
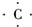
+4H?→
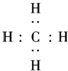
,故答案为:
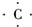
+4H?→
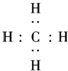
;
(4)A和B的单质充分反应生成化合物为CO2,电子式为
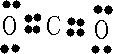
,故答案为:
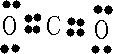
;
(5)B与C形成的化合物为MgO,为离子化合物,可用熔融状态下是否导电验证,离子化合物在熔融状态下导电,而共价化合物不导电,
故答案为:离子化合物;检验方法为:验证其熔融物是否导电,若导电则为离子化合物,若不导电则为共价化合物.
本题解析:
本题难度:一般
2、选择题 下列各组物质中,分子中的所有原子都满足最外层8 电子结构的是
A.BeCl2、PCl5
B.PCl3、N2
C.COCl2(光气)、SF6
D.XeF2、BF3
参考答案:B
本题解析:A错,BeCl2中Be最外层未满足8电子结构,PCl5 中P原子不是8电子结构;B正确,分子中所有原子满足最外层8电子结构;C错SF6中S元素原子不是8电子结构;D错,XeF2中Xe不是8电子结构,BF3中B未满足8电子结构;
本题难度:一般
3、填空题 (10分)甲、乙、丙、丁为前三周期元素形成的微粒,它 们的电子总数均为14。
们的电子总数均为14。
已知:甲为原子;乙、丙、丁为双 原子分子或离子。
原子分子或离子。
⑴甲单质与氢氧化钠溶液反应的离子方程式为 ? ? ? ;
⑵乙是双原子分子,在高温时是一种还原剂。14 g乙燃烧放出的热量是141.5 kJ。写出乙燃烧的热化学方程式?。
⑶丙为双原子二价阴离子,与钙离子组成的化合物能跟水反应产生一种可燃性气体。该可燃性气体能与乙酸在一定条件下,按物质的量比1∶1发生加成反应生成一种酯,该化学方程式是为?。
⑷由丁分子组成的物质属于单质,组成丁的元素最高价氧化物对应的水化物X有下图所示转化关系(反应条件和其他物质已略)
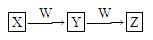
已知W为金属单质,W在周期表中的位置 ? ? 。
写出X的稀溶液与Z反应的离子方程式:?。
参考答案:
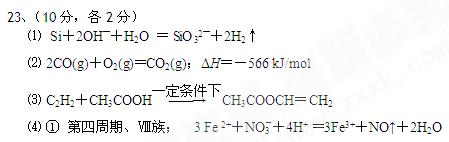
本题解析:略
本题难度:一般
4、填空题 填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:______;
(2)周期表中最活泼的非金属元素位于第______族;
(3)所含元素种类是8种的周期是第______、______周期.
参考答案:(1)质子数为8的原子为氧原子,则含8个质子、10个中子的原子的质量数=8+10=18,化学符号为188O,
故答案为:188O;
(2)非金属强的元素在元素周期表中的右上方的位置,在每个周期中第ⅦA族元素的非金属性最强,在第ⅦA族中Cl元素的非金属性最强,故答案为:ⅦA;
(3)短周期包括一、二、三周期,第一周期有2种元素,第二、三周期都含有8种元素,故答案为:二;三.
本题解析:
本题难度:一般
5、选择题 下列含有极性键的非极性分子是( )
(1)CCl4?(2)NH4?(3)CH4?(4)CO2?(5)N2
(6)H2S?(7)SO2?(8)CS2?(9)H2O?(10)HF.
A.(2)(3)(4)(5)(8)
B.(1)(3)(4)(5)(8)
C.(1)(3)(4)(8)
D.以上都不对
参考答案:(1)CCl4为正四面体结构,含有极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子;?
(2)NH4+为正四面体结构,含有极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子;
(3)CH4?为正四面体结构,含有极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子;?
(4)CO2中有C、O元素之间形成极性键,且分子结构对称,正负电荷的中心重合,属于非极性分子;
(5)N2中只有N-N非极性键,属于非极性分子;
(6)H2S中有H、S元素之间形成极性键,分子结构不对称,正负电荷的中心不重合,属于极性分子;?
(7)SO2中有O、S元素之间形成极性键,分子结构不对称,正负电荷的中心不重合,属于极性分子;?
(8)CS2中有C、S元素之间形成极性键,且分子结构对称,正负电荷的中心重合,属于非极性分子;?
(9)H2O中H、O元素形成的极性键,但结构不对称,属于极性分子;?
(10)HF中H、F元素形成的极性键,但结构不对称,属于极性分子.
故选D.
本题解析:
本题难度:简单