微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
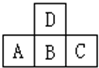
1、填空题 (1)由A、B两元素组成的离子晶体结构(甲)如图所示,则该晶体的化学式是:___________。
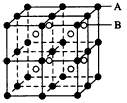
(2)C原子的最外层电子排布为nsnnpm,其某一激发态可使这两个亚层的每一个轨道都处于全满状态,1个C原子与2个D原子结合,使双方都达到8电子稳定结构。则在C与D形成的分子中,C原子发生轨道的杂化方式是________,分子构型是________,从成键方式看,该分子中含有的共价键的类型和数目分别是________________
(3)C与D形成的常见晶体(乙),与甲晶体的熔点相比,乙____甲,其原因是___________________。
2、选择题 化学科学需要借助化学专用语言描述.下列有关化学用语正确的是( )
A.CO2的电子式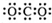
B.乙烯分子的结构式
C.乙酸的结构简式C2H4O2
D.硫原子的原子结构示意图:
3、填空题 (12分)A、B、C、D、E、F、G七种前四周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
(1)写出F元素基态原子的核外电子排布式?;
(2)B、C、D三种元素电负性由大到小的顺序是?(用元素符号表示);
(3)下列有关上述元素的说法,正确的是?(填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为?,1 mol B2A4分子中含有?molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是?。
说明:O摄氏度=273K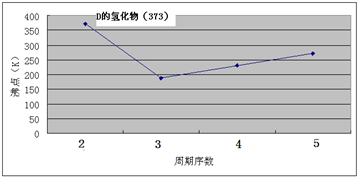
4、选择题 干冰气化时,下列所述内容发生变化的是(? )
A.分子内共价键
B.分子间的氢键
C.分子的个数
D.分子间作用力
5、填空题 如图中A、B、C、D是同周期或同主族的相邻元素:
①已知:A元素的最低价为-3价,它的最高价氧化物含氧56.34%,原子核内中子数比质子数多1个,则A元素原子质量数为______,原子序数为______,A元素位于第______周期______族.
②写出元素符号A:______,B:______,C:______,D:______.
③A、B、C三种元素最高价氧化物的水化物的化学式依次为______,______,______,其中酸性最强的是______.
④B、D两种元素和氢组成的气态氢化物的化学式依次为______,______其中______稳定性最大,______还原性最强.