微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 1.76克铜镁合金完全溶解于50mL、密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2气体1792mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是(? )
A.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
B.加入NaOH溶液的体积是50mL
C.浓硝酸在与合金反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08mol
D.得到的金属氢氧化物的沉淀为3.12克
参考答案:B
本题解析:A、根据C =1000ρω/M即可计算该浓硝酸的物质的量浓度;设合金的物质的量为a mol,根据电子守恒可得:2a=1.792/22.4,所以a=0.04mol。硝酸由三部分组成:表现酸性的、表现氧化性的、过量的,除了表现氧化性的变成二氧化氮,其余的最后都生成硝酸钠,所以n(NaOH)= n(HNO3)总-0.08=0.7-0.08=0.62mol,c(NaOH)=0.62mol/L,故B错误,C正确;D、沉淀的质量=合金质量+氢氧根质量=1.76+0.04×2×17=3.12g,正确。
本题难度:一般
2、选择题 在强酸性溶液中可发生如下反应:
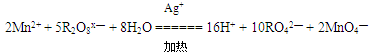
这个反应可定性地检验Mn2+ 的存在。在反应中充当氧化剂的R2O8 x— 中x的值是:(?)
A.0
B.1
C.2
D.3
参考答案:C
本题解析: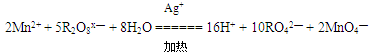 ,Mn2+ ?2mol,失电子2×5mol,5molR2O8 x— 得电子10mol,每摩尔R化合价降低1价,反应后R化合价为+6价,反应前为+7价,则x=2。
,Mn2+ ?2mol,失电子2×5mol,5molR2O8 x— 得电子10mol,每摩尔R化合价降低1价,反应后R化合价为+6价,反应前为+7价,则x=2。
本题难度:简单
3、填空题 绿矾(FeSO4?7H2O)是中学阶段常用的一种还原剂。
(1)久置的绿矾溶液容易被空气氧化变质,简述检验绿矾溶液已经变质的操作和现象:取少量待测液于试管中,?。
(2)绿矾溶液浓度的标定测定溶液中Fe2+物质的量浓度的方法是:
a.量取25.00mL待测溶液于锥形瓶中;
b.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点;
c.重复操作2次,消耗KMnO4溶液体积的体积分别为20.02mL、24.98mL、19.98mL。
(已知滴定时发生反应的离子方程式为5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①判断此滴定实验达到终点的方法是?。
②计算上述滤液中Fe2+物质的量浓度?(保留四位有效数字)。
(3)探究保存绿矾溶液的有效措施
【反应原理】Fe2+在空气中易氧化变质,完成并配平下列离子方程式:
?Fe2+ +?O2 + ???= ?Fe(OH)3↓+ ?Fe3+?
【操作与现象】取4支试管,如图进行实验,请在相应位置上写出试管①的现象和④的添加试剂。

【分析与结论】设计试管①的作用是?;为了有效保存FeSO4溶液,你认为最佳方案为?。
参考答案:(1)向其中滴入2~3滴的KSCN溶液,震荡,溶液变成红色。?(2分)
(2)①当最后一滴KMnO4溶液滴入锥形瓶后,瓶内溶液变成浅红色且半分钟内不褪色。
(2分)
②0.04000 mol/L?(3分,计算结果1分,有效数字1分,单位1分)
(3)【反应原理】 12、3、6 H2O;4、8?(3分,物质1分,配平2分)
【操作与现象】少量(3滴)硫酸(2分);?溶液颜色很快变成黄色,并出现棕黄色浑浊(2分)
【分析与结论】作空白对照实验(1分);
用煤油隔绝空气,并加入少量的铁屑和稀硫酸(2分)
本题解析:(1)久置的绿矾溶液容易被空气氧化变质,实质是其中的亚铁离子容易被氧化为铁离子,所以检验是否变质的方法是检验样品中是否含有铁离子,可选用KSCN试剂,操作是向其中滴入2~3滴的KSCN溶液,震荡,溶液变成红色。
(2)①使用紫红色的酸性高锰酸钾溶液滴定亚铁离子,所以到达终点时的现象是,最后一滴KMnO4溶液滴入锥形瓶中溶液颜色变成浅红色,且在半分钟内不褪色。
②实验中分了3次进行滴定,但是第2组数据消耗KMnO4溶液体积24.98ml明显高于其它2组,所以该数据应该舍去,所以消耗KMnO4溶液平均体积=(20.02mL+19.98mL)/2=20.00ml,所以根据方程式比例可得亚铁离子的浓度c(Fe2+)=5n(MnO4—)/V(Fe2+)="5×0.01000mol/L×20.00ml/25.00ml=0.04000" mol/L。计算中要注意有效数字的保留。
(3)【反应原理】此处考察的是氧化还原反应的缺项配平,根据产物Fe(OH)3 中含有H,可以推测原反应物必有水参加,所以缺项处为H2O;再根据氧化还原的特点找出化合价变化的Fe和O,用得失电子守恒来进行配平,可得到方程式为12Fe2+ +3O2 +6 H2O = 4Fe(OH)3↓+ 8Fe3+ 。
【操作与现象】由图中所给的四个试管和添加试剂可以看出,这四组实验目的是在比较在不同条件下FeSO4溶液的保存效果。所以领会题目意图,要充分应用上一题的反应方程式12Fe2+ +3O2 +6 H2O = 4Fe(OH)3↓+ 8Fe3+来解题。试管①对硫酸亚铁溶液没有做任何处理,试管①自然会发生反应式中的现象,亚铁离子很快被氧化为棕黄色的铁离子,同时还会有Fe(OH)3 沉淀产生。鉴于试管①,试管②添加了一层煤油以使溶液隔绝氧气,此方法必然会减缓亚铁离子被氧化;试管③添加了铁粉,铁粉可以把铁离子还原为亚铁离子,起到防氧化的目的,氧化减慢;考虑到亚铁离子除了被氧化之外,还容易发生水解,所以试管④中应该添加几滴稀硫酸溶液。
【分析与结论】所以综上所述,试管①设计意图只是用于作空白对照实验,而保存FeSO4溶液最佳方案应该是综合②③④操作,用煤油隔绝空气,并加入少量的铁屑和稀硫酸。
本题难度:一般
4、选择题 取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL的NO2气体和672 mL N2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02 g。则x等于(?)
A.8.64 g
B.9.20 g
C.9.00 g
D.9.44 g
参考答案:B
本题解析:铜镁合金的质量等于沉淀质量减去OH-的质量,n(OH-)=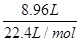 ×1+
×1+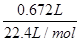 ×2=0.46 mol,其质量为0.46 mol×17 g·mol-1=7.82 g
×2=0.46 mol,其质量为0.46 mol×17 g·mol-1=7.82 g
铜镁合金质量为17.02 g-7.82 g=9.20 g,B正确。
本题难度:一般
5、选择题 用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)? ΔH=-574kJ·mol—1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)? ΔH=-1160kJ·mol—1
下列说法不正确的是:
A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ΔH=-Q,Q>574kJ·mol—1
B.等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同
C.若用标准状况下4.48L CH4还原NO2至N2,放出的热量为173.4kJ
D.若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总物质的量为1.6mol
参考答案:B
本题解析:A、①反应中水的状态是气态,而CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ΔH=-Q中,水是液态,从气态到液态要放出热量,所以Q>574kJ·mol—1,正确;B、甲烷对应的氧化产物都是CO2,所以等物质的量的甲烷分别参加反应①、②,反应转移的电子数相同,错误;C、将两个方程式相加得CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g)? ΔH=-867kJ·mol—1,所以用标准状况下4.48L CH4还原NO2至N2,放出的热量为4.48L/22.4L/mol×867kJ·mol—1=173.4kJ,正确;D、标准状况下4.48L CH4的物质的量为0.2mol,所以转移电子的物质的量为0.2mol×8=1.6mol,正确,答案选B。
本题难度:一般