微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NH3氧化制硝酸时,在吸收塔里发生如下反应:3NO2+3H2O 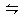 2HNO3+NO △H<0,为了提高HNO3的产量,在理论上应该采取的措施是(?)
2HNO3+NO △H<0,为了提高HNO3的产量,在理论上应该采取的措施是(?)
A.降温
B.升温
C.减压
D.增压
参考答案:AD
本题解析:依据反应的特点,要使平衡向有利于HNO3的产量的增大的方向移动,可采取降温和加压的措施。
本题难度:一般
2、选择题 可逆反应:2NO2(g)?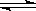 ?2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是?( ?)
?2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是?( ?)
①单位时间内生成n mol O2的同时生成2n mol NO2;②NO2和NO的物质的量浓度相等;③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态;④混合气体的密度不再改变的状态;⑤混合气体的颜色不再改变的状态
A.①⑤
B.①②③⑤
C.①③④
D.①②③④⑤
参考答案:A
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。①中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,可以说明;平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,②不能说明。速率之比是相应的化学计量数之比,因此③中的关系始终是成立,不能说明;密度是混合气的质量和容器容积的比值,在反应过程中容积和气体的质量始终是不变的,因此密度始终是不变的,因此选项④不能说明;颜色深浅和浓度有关系,混合气体的颜色不再改变,这说明NO2的浓度不再发生变化,所以⑤正确,答案选A。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。
本题难度:一般
3、选择题 在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g) 2Z(g)
2Z(g)
此反应达到平衡的标志是
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1∶2∶2
D.单位时间消耗0.1 mol X同时生成0.2 mol Z
参考答案:AB
本题解析:正反应是气体物质的量减小的反应,容器内压强不随时间变化时,即气体的物质的量不再变化,各物质的浓度也不再变化,表明该反应达到了平衡状态。
本题难度:一般
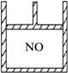
4、选择题 下图为装有活塞的密闭容器,内盛22.4 mL一氧化氮。若通入11.2 mL氧气(气体体积均在标准状况下测定)保持温度、压强不变,则容器内气体的密度(? )
A.等于1.369 g/L
B.等于2.054 g/L
C.在1.369 g/L和2.054 mol/L之间
D.大于2.054 g/L
参考答案:D
本题解析:标准状况下,22.4 mL一氧化氮的物质的量为0.001mol;11.2 mL氧气的物质的量为0.0005mol;由方程式2NO+O2=2NO2可知,两气体恰好完全反应生成0.01molNO2气体;气体物质的量的减少,为保持压强不变,气体体积减小,又因为二氧化氮气体存在如下可逆反应: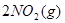 ?
? ,则可得容器内气体的密度大于2.054 g/L
,则可得容器内气体的密度大于2.054 g/L
本题难度:一般
5、选择题 下列关于可逆反应的叙述正确的是( )
A.可逆反应是指既能向正反应方向进行,同时又能向逆反应方向进行的反应
B.2H2O 2H2+O2与2H2+O2
2H2+O2与2H2+O2 2H2O互为可逆反应
2H2O互为可逆反应
C.对于可逆反应,当正反应速率增大时,逆反应速率就会减小
D.外界条件对可逆反应的正、逆反应速率影响的程度不一定相同
参考答案:D
本题解析:A、只有条件相同、正逆反应同时进行的化学反应才是可逆反应,故A错误.
B、2H2O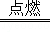 2H2+O2与2H2+O2
2H2+O2与2H2+O2 2H2O的反应条件不同,所以不是可逆反应,故B错误.
2H2O的反应条件不同,所以不是可逆反应,故B错误.
C、对于可逆反应,当正反应速率增大时,逆反应速率可能会增大,可能会不变,故C错误.
D、外界条件对可逆反应的正、逆反应速率影响的程度不一定相同,所以可能导致化学平衡移动,故D正确.
故选D.
点评:本题考查了可逆反应的定义,难度不大,注意可逆反应必须是两个“同”,即条件相同,正逆反应同时进行,只有同时具备这两个条件的化学反应才是可逆反应.
本题难度:简单