微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化学用语的书写正确的是
[? ]
A.氯气分子的电子式Cl∶Cl
B.氢气分子的电子式H∶H
C.氯化镁的电子式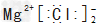
D.氯化钠的电子式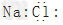
参考答案:B
本题解析:
本题难度:简单
2、填空题 已知A、B、C、D均是元素周期表中前36号中的元素,其原于序数依次递增,其他相关结构或性质信息如下表。
元素
| 结构或性质信息
|
A
| 原子核外有一个未成对电子,其氢化物与水分子间能形成氢键
|
B
| 原子核外M层电子数是N层电子数的4倍
|
C
| 是使用最为广泛的合金的主要成分
|
D
| 原子各内层电子均已饱和,最外层电子数为1
|
?
请根据信息回答有关问题:
(1)C元素在周期表中的位置为____?,D元素原子的外围电子排布式为?
(2)用氢键表示式写出A的氢化物水溶液中存在的所有氢键____?。
(3)A与氧可形成原子个数比为2:1的三原子分子,其中氧的化合价为____?,氧原子杂化类型与下列分子的中心原子杂化类型相同的是____?
a:CO2?b:SO2? c:NH3?d;CH4
(4)A、B可形成离子化合物,其晶胞结构如下图甲所示,则晶胞中B离子的个数为____?,与B离子最近且等距的A离子的个数为?。
(5)1183 K以下C晶体的晶胞如图乙中图1,而1183 K以上则转变为图2,在两种晶胞中最邻近的C原子间距离相同,则图1、图2所示两种晶中原子的空间利用率之比为___? _(可用根号表示)。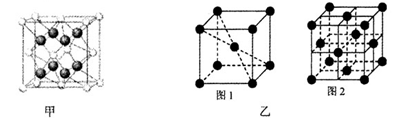
参考答案:(1)第四周期Ⅷ族(1分)? 3d104s1(2分)
(2)F—H…F、F—H…O、O—H…F、O—H…O(4分或其他正确表示)
(3)+2(1分)cd(2分)
(4)4(1分)? 8(1分)
(5)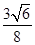 或0.92:1或68%:74%等合理答案均给分(3分)
或0.92:1或68%:74%等合理答案均给分(3分)
本题解析:原子核外有一个未成对电子,其氢化物与水分子间能形成氢键,因此A是F元素;原子核外M层电子数是N层电子数的4倍,这说明M是20号元素Ca;C是使用最为广泛的合金的主要成分,因此C是铁元素;原子各内层电子均已饱和,最外层电子数为1,则D是29号元素Cu。
(1)铁元素在周期表中的位置为第四周期Ⅷ族;铜元素原子的外围电子排布式为3d104s1。
(2)F和O都是活泼的非金属,能形成氢键,所以A的氢化物水溶液中存在的所有氢键为F—H…F、F—H…O、O—H…F、O—H…O。
(3)F的非金属性强于氧元素,在化合物中F只有-1价,所以如果A与氧可形成原子个数比为2:1的三原子分子,则其中氧的化合价为+2价。在该分子中氧元素含有的孤对电子对数=(6-2×1)÷2=2,因此 该分子是V形结构,氧元素是sp3杂化。CO2、SO2、NH3、CH4分子中中心原子的杂化轨道类型分别是sp、sp2、sp3、sp3,所以答案选cd。
(4)A、B形成离子化合物是CaF2,则根据晶胞结构可知,晶胞中B离子的个数为=8× +6×
+6×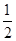 =4个;与B离子最近且等距的A离子的个数为8个。
=4个;与B离子最近且等距的A离子的个数为8个。
(5)设铁原子半径是r,立方体边长图1是a,图2是b,则根据图1可知a2+2a2=(4r)2,解得a=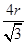 ,所以图1中铁原子的空间利用率是
,所以图1中铁原子的空间利用率是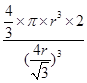 。根据图2可知b2+b2=(4r)2,解得b=
。根据图2可知b2+b2=(4r)2,解得b=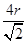 ,所以图2中铁原子的空间利用率是
,所以图2中铁原子的空间利用率是 ,所以铁原子的空间利用率之比为
,所以铁原子的空间利用率之比为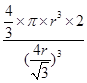 :
: =
=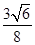 。
。
本题难度:一般
3、选择题
下列化合物中既存在离子键,又存在极性键的是 (? )





 ?
?
A.H2O
B.NH4Cl
C.NaOH
D.Na2O2
参考答案:
答案:B C
本题解析:
水分子中只有H-O键,是极性键,无离子键,排除A项;NH4Cl中NH4+和Cl-间是离子键,NH4+内N和H原子以极性键结合,B项正确;NaOH中Na+和OH-以离子键结合,OH-内H和O之间以极性键结合,C项正确;Na2O2中Na+和O22-以离子键结合,O22-内有非极性键,排除D项。
本题难度:一般
4、选择题 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是 (?)
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
C.用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
参考答案:B
本题解析:向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,这说明生成的是氢氧化铜蓝色沉淀。继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,这是由于氢氧化铜和氨气反应生成了配合离子[Cu(NH3)4] 2+,其中氨气是配体,提供孤对电子,铜离子提供空轨道,所以正确的答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,侧重对学生基础知识的巩固和检验。旨在考查学生灵活运用配位健理论解决实际问题的能力,有利于调动学生的学习兴趣和学习积极性,提高学生的应试能力。
本题难度:一般
5、简答题 在下列物质中:①碘单质②烧碱晶体③NaCl晶体④干冰⑤固态氯化氢⑥Na2O2晶体.选择合适的物质,用序号填空:
(1)既含有离子键又含有非极性共价键的化合物是______.
(2)仅含有离子键的化合物是______.
(3)仅含有共价键的化合物是______.
参考答案:①碘单质中只含共价键;
②烧碱中钠离子和氢氧根离子间存在离子键,氧原子和氢原子之间存在极性共价键;
③NaCl中钠离子和氯离子之间存在离子键;
④干冰分子中氧原子和碳原子之间存在共价键;
⑤氯化氢中氯原子和氢原子之间存在共价键;
⑥Na2O2中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在非极性共价键;
故答案为:(1)⑥(2)③(3)①④⑤.
本题解析:
本题难度:一般