微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
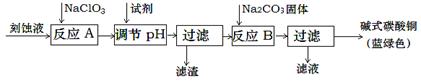
1、填空题 碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下:
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质
| Cu(OH)2
| Fe (OH)2
| Fe (OH)3
|
开始沉淀pH
| 4.2
| 5.8
| 1.2
|
完全沉淀pH
| 6.7
| 8.3
| 3.2
|
?
(1)氯酸钠的作用是?;滤渣的主要成分是?(写化学式)。
(2)调节反应A后溶液的pH范围应为?。可以选择的试剂是?(填序号)。
a.氨水 ?b.稀硫酸? c.氢氧化钠? d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是?。(写化学式)
(4)过滤得到的产品洗涤时,如何判断产品已经洗净??。
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。
① 若沉淀只有CuCO3,则相应的离子方程式为?。
② 若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程?。
③ 若生成Cu(OH)2和CuCO3的混合物(即碱式盐)。则说明????。
(6)碱式碳酸铜组成可表示为:aCuCO3?bCu(OH)2?cH2O,现通过下列方案测定其组成。步骤如下:
① 称量样品;② 高温分解;③ 测出CO2的质量;④ 测出水蒸汽的质量;⑤ 称量CuO。
请对上述测定方案作出评价。????。
2、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是(? )

A.CaSO4在稀硫酸中的溶解性比在纯水中的溶解性强
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.d点溶液通过蒸发可以变到c点
D.a点对应的Ksp等于c点对应的Ksp
3、填空题 水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、
Pb(OH)3-、Pb(OH)42-。各形态的浓度分数α随溶液pH 变化的关系如图所示:【图中1表示Pb2+,2表示
Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3-,5表示Pb(OH)42-】
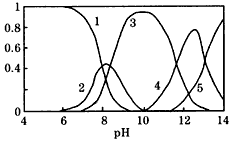
(1)往Pb(NO3)2溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子除H+、 Na+ 外还有__________,pH=9时,主要反应的离子方程式为_______________________。
(2)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
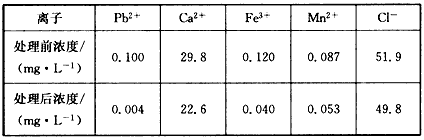
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是_________。
(3)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+ E2Pb(s) +2H+。则脱铅的最合适pH 范围为___(填代号)。
E2Pb(s) +2H+。则脱铅的最合适pH 范围为___(填代号)。
A.4 ~5
B.6 ~7
C.9~10
D.11~12
4、选择题 已知298K时,Ksp(CaCO3)= 2.80×10-9,Ksp(CaSO4)= 4.90×10-5。若用难溶盐在溶液中的物质的量浓度来表示其溶解度,则下面的叙述正确的是(? )
A.298K时,CaSO4的溶解度约为7.00×10-2 mol/L
B.反应CaSO4(s) + CO32-= CaCO3(s) + SO42-在298K时的平衡常数K= Ksp(CaSO4) / Ksp(CaCO3) = 1.75×104
C.CaCO3、CaSO4的饱和溶液的导电能力很弱,所以它们都是弱电解质
D.升高温度,两种盐的溶度积与溶解度都保持不变
5、填空题 (12分)
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Co(OH)2
| Al(OH)3
|
开始沉淀
| 2.3
| 7.5
| 7.6
| 3.4
|
完全沉淀
| 4.1
| 9.7
| 9.2
| 5.2
|
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为? ? ??。
? ??。
(2)加入碳酸钠调节pH至a,a的范围是?;
(3)操作Ⅰ包含3个基本实验操作,它们是?、?和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是? ?。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是?(任写1点)。