|
高中化学必备知识点《化学反应速率》高频试题预测(2017年最新版)(二)
2017-08-01 02:32:49
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下将0.1 mol N2和0.3 mol H2置于密闭容器中发生反应N2+3H2 2NH3。下列关于该反应的说法正确的是( ) 2NH3。下列关于该反应的说法正确的是( )
A.最终可生成0.2 mol NH3
B.使用催化剂不影响反应速率
C.增大压强反应速率减小
D.升高温度反应速率增大
|
参考答案:D
本题解析:A.由于该反应是可逆反应,物质不能完全转化,所以最终不可生成0.2 mol NH3 ,错误;B.使用催化剂不影响化学平衡,但是能够使反应速率大大加快,错误;C.增大压强,物质的浓度增大,反应速率增大,错误;D.升高温度,更多的分子变为活化分子,所以反应速率增大 ,正确。
考点:考查外界条件对化学反应速率和化学平衡移动的影响的知识。
本题难度:一般
2、实验题 (8分)某同学用相同质量的锌和相同浓度足量的稀盐酸反应得到实验数据如下
实验编号
| 锌的状态
| 反应温度/℃
| 收集100mL氢气所需时间
| ①
| 薄片
| 15
| 200
| ②
| 薄片
| 25
| 90
| ③
| 粉末
| 25
| 10
|
(1)该实验的目的是研究??、?对锌和稀盐酸反应速率的影响。
(2)实验①和②表明??;
(3)能表明固体的表面积对反应速率影响的实验编号是??和??。
(4)要加快该反应速率,除了上述表中的因素外,你试举出两条??。?
参考答案:(1)温度和固体的接触面积(固体的形状)
(2)其它条件不变时,升高温度,化学反应速率加快;?(3)②和③
(4)增加盐酸的浓度、加入少量的硫酸铜形成原电池(加入铜粉)或用粗锌
本题解析:(1)在反应中锌的固体表面积和反应的温度是不同的,所以实验的目的是研究温度和固体的接触面积对反应速率的影响的。
(2)实验①②中温度不同,温度越高,收集等条件氢气所用的时间就越少,即温度升高,反应速率加快。
(3)实验②③中温度相同,但固体的表面积是不同的。
(4)影响化学反应速率的因素除了温度和固体的接触面积之外,还可以是反应物的浓度,或者通过原电池反应来加快反应速率等。
本题难度:一般
3、选择题 4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率 4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率 (X)(反应物的消耗速率或产物的生成速率)可表示为 (X)(反应物的消耗速率或产物的生成速率)可表示为
参考答案:
本题解析:
本题难度:一般
4、实验题 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
编号
| 操作
| 实验现象
| ①
| 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。
| 试管A中不再产生气泡;
试管B中产生的气泡量增大。
| ②
| 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液
| 试管A、B中均未明显见到有气泡产生。
|
?
(1)过氧化氢分解的化学方程式为__________________________________________。
(2)实验①的目的是______________________________________________________。实验中滴加FeCl3溶液的目的是_________________________________________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是__________________________________(用实验中所提供的几种试剂)。
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最慢的是______________________。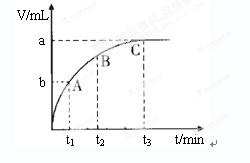
参考答案:(10分)(1)2H2O2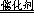 2H2O+O2↑(2分) 2H2O+O2↑(2分)
(2)研究温度对H2O2分解速率的影响(2分)
加快H2O2分解速率,使实验现象易于观察(2分)
(3)将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率(2分)
(4)C点的即时速率(2分)
本题解析:(1)过氧化氢不稳定,容易分解生成水和氧气,则2H2O2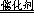 2H2O+O2↑;(2)实验①中过氧化氢的浓度和体积相同,氯化铁溶液的浓度和体积也相同,只有反应温度不同,分别是5℃、40℃,根据控制变量设计实验探究的规律,实验①的目的是研究温度对H2O2分解速率的影响;氯化铁溶液是双氧水分解反应的催化剂,实验中滴加氯化铁溶液的目的加快反应速率,,使实验现象易于观察;(3)实验②中过氧化氢溶液的体积相同,浓度不同,说明该实验的目的是研究浓度对双氧水分解速率的影响,因此其他条件相同即可,为了加快反应速率,便于观察实验现象,改进的方法可以是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率;(4)随着反应的进行,双氧水的物质的量逐渐减小,其浓度逐渐减小;减小反应物浓度,反应速率减小,则图中A、B、C点所表示的双氧水浓度大小关系为:A>B>C,因此三点表示的瞬时反应速率大小顺序是A>B>C,所以C点所表示的反应速率最慢。 2H2O+O2↑;(2)实验①中过氧化氢的浓度和体积相同,氯化铁溶液的浓度和体积也相同,只有反应温度不同,分别是5℃、40℃,根据控制变量设计实验探究的规律,实验①的目的是研究温度对H2O2分解速率的影响;氯化铁溶液是双氧水分解反应的催化剂,实验中滴加氯化铁溶液的目的加快反应速率,,使实验现象易于观察;(3)实验②中过氧化氢溶液的体积相同,浓度不同,说明该实验的目的是研究浓度对双氧水分解速率的影响,因此其他条件相同即可,为了加快反应速率,便于观察实验现象,改进的方法可以是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率;(4)随着反应的进行,双氧水的物质的量逐渐减小,其浓度逐渐减小;减小反应物浓度,反应速率减小,则图中A、B、C点所表示的双氧水浓度大小关系为:A>B>C,因此三点表示的瞬时反应速率大小顺序是A>B>C,所以C点所表示的反应速率最慢。
本题难度:一般
5、选择题 在可逆反应中,改变下列条件一定能加快反应速率的是
[? ]
A.增大反应物的量
B.升高温度
C.增大压强
D.加催化剂
参考答案:B
本题解析:
本题难度:一般
| 