?
?
参考答案:I.H2O2MnO2 H2O+O2↑(2分)、2Na2O2+2H2O=4NaOH+O2↑。(2分)(其它方法合理均给分)
II.(1)试管中有大量气泡产生,带火星的木条复燃;(2分)
(2)?甲 (1分) ;因过氧化氢溶液中自身有水,可见水不是催化剂。(1分)
(3) (每空2分)
实验过程
实验现象
结论
?
?
起催化作用的不是Cl-
?
?
起催化作用的是Fe3+
本题解析:I.制取氧气,可用双氧水分解、氯酸钾分解或高锰酸钾分解,也可用利用过氧化钠和水反应制取氧气。
II.(1)氯化铁能作为双氧水分解的催化剂,所以会产生氧气,氧气能使带火星的木条复燃。
(2)由于过氧化氢溶液中就含有大量的水,所以水不可能是催化剂。
(3)加入盐酸,不能产生氧气,这说明起催化剂作用的不是氯离子。而加入硫酸铁能够产生大量的氧气,就说明起催化剂作用的是铁离子。
本题难度:一般
2、选择题 实验室可利用反应“Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O”制取SO2,下列措施能降低该化学反应速率的是( )
A.适当降低反应温度
B.用铜粉代替铜片
C.加入MnO2作催化剂
D.将浓硫酸改为稀硫酸
参考答案:A、常温下铜与浓硫酸不反应,适当降低温度可以使化学反应速率减慢,故A正确;
B、用铜粉代替铜片,增大接触面积,加快反应速率,故B错误;
C、加入MnO2对该反应没有影响,故C错误;
D、铜与稀硫酸不反应,不能生成二氧化硫,故D错误.
故选A.
本题解析:
本题难度:一般
3、填空题 (6分)(1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择 (填序号)。
①1mL 0.01 mol·L—1的碘水 ②1mL 0.001 mol·L—1的碘水
③4mL 0.01 mol·L—1的Na2S2O3溶液 ④4mL 0.001 mol·L—1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算υ(S2O32—)=
参考答案: (1)②③④(3分)(各1分,少1扣1,错1全扣)
(2)8.3×10—4mol·L—1·s—1(3分)
本题解析:(1)考查外界条件对反应速率的影响。根据反应的方程式可知,如果选择①,则在④中,Na2S2O3是不足的,碘水是过量的,因此溶液不褪色,正确的答案选②③④。
(2)根据方程式可知,消耗Na2S2O3的物质的量浓度是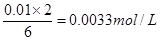 ,所以υ(S2O32—)= ,所以υ(S2O32—)=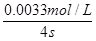 =8.3×10—4mol·L—1·s—1。 =8.3×10—4mol·L—1·s—1。
本题难度:一般
4、填空题 (15分)在100℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,发生反应:
2NO2 N2O4。每隔一定时间就对该容器内的物质进行分析,得到如下表数据: N2O4。每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
时间/s
| 0
| 20
| 40
| 60
| 80
| n(NO2)/mol
| 0.40
| n1
| 0.26
| n3
| n4
| n(N2O4)/mol
| 0.00
| 0.05
| n2
| 0.08
| 0.08
|
?
(1)在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为__________
mol/(L·s)。
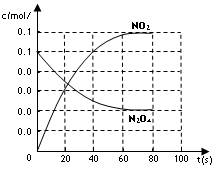
(2)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是_________mol/L。假设在80s时达到平衡,请在如图中画出该条
件下N2O4和NO2的浓度随时间变化的曲线。
(3)上述(2)达到平衡后四氧化二氮的转化率为_________,混合气体的平均摩尔质量
为___________。
(4)达到平衡后,如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,则平衡将?(填“向左移动”、“向右移动”或“不移动”)。
参考答案:(1)2.5×10-3(2分)?(2)0.10(2分)?如下图(3分)
(3)60%(3分)? 57.5g/mol (3分)?(4)向左移动(2分)
本题解析:略
本题难度:简单
5、填空题 在下列事实中,什么因素影响了化学反应的速率?
(1)集气瓶中有H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸__________;
(2)黄铁矿煅烧时要粉碎成细小的矿粒__________;
(3)KI晶体和HgCl2晶体混合后无明显现象,若一起投入水中,很快生成红色HgI2________;
(4)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体________________;
(5)同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢______;
(6)同样大小的石灰石分别在0.1 mol/L的盐酸和1 mol/L的盐酸中反应速率不同__________;
(7)夏天的食品易变霉,冬天就不易发生该现象______。
参考答案:(1)光
(2)反应物的接触面积
(3)在溶液中,水作溶剂,增大了接触面积
(4)催化剂
(5)反应物本身的性质
(6)反应物的浓度
(7)反应温度
本题解析:
本题难度:一般
|