微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将a mol钠和a mol铝一同投入m g足量的水中,所得溶液的密度为dg· 该溶液的质量分数为( )
该溶液的质量分数为( )
A.
B.
C.
D.
参考答案:C
本题解析:溶质为 ,质量为82a,溶液质量为23a+27a+m-4a=46a+m.
,质量为82a,溶液质量为23a+27a+m-4a=46a+m.
本题难度:一般
2、填空题 以硫铁矿烧渣(含有氧化铁和少量硫化亚铁、二氧化硅等)为原料制备聚铁{可表示为Fe2(OH)n(SO4)3-n/2,和绿矾(FeSO4.7H2O)具有成本低、反应快、产品质量高等优点。制备流程如下图:
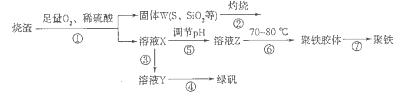
(1)流程图中溶液X为Fe(SO4)3,溶液,据此写出操作①中属于氧化还原反应的离子方程式:____________。
(2)操作②的处理存在弊端,该弊端是_____________。若固体W与KOH溶液昆合加热,其中一个反应的化学方程式为3S+6KOH 2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
(3)操作③需要加入的物质(试剂)是_________,目的是___________________________。
(4)操作⑤是使溶液pH___________(填“增大”或“减小”)。
(5)操作⑥控制温度为70 -80℃的目的是_________________________________________ 。
(6)双氧水在酸性环境(硫酸)中是一种强氧化剂,可以将硫酸亚铁氧化成三价铁,制得Fe2(OH)n(SO4)3-n/2,反应的化学方程式为__________________________________。
参考答案:(1)4FeS+3O2+12H+=4Fe3++6H2O+4S
(2)燃烧产物SO2会造成环境污染? 2:1
(3)铁粉?使Fe3+还原为Fe2+
(4)增大
(5)促进Fe3+水解。又不至于Fe3+完全水解生成氢氧化铁胶体
(6)2FeSO4+H2O2+(1-n/2)H2SO4=Fe2(OH)n(SO4)3-n/2+(2-n)H2O
本题解析:(1)氧化还原反应的特征是元素的化合价的升降。发生的反应中属于氧化还原反应的为:4FeS+3O2+12H+=4Fe3++6H2O+4S。
(2)在固体W中含有S、SiO2,在灼烧时S被氧化为SO2而逸出,导致环境污染。在反应3S+6KOH 2K2S+K2SO3+3H2O中,S既作氧化剂,也作还原剂,其中2个S作氧化剂,1个S作还原剂。所以该反应的氧化剂与还原剂质量之比为2:1。
2K2S+K2SO3+3H2O中,S既作氧化剂,也作还原剂,其中2个S作氧化剂,1个S作还原剂。所以该反应的氧化剂与还原剂质量之比为2:1。
(3)溶液X为Fe(SO4)3,向其中加入Fe粉使硫酸铁还原为硫酸亚铁,然后蒸发、结晶得到绿矾。
(4)操作⑤是使溶液pH增大以抑制Fe3+的水解。
(5)操作⑥控制温度为70 -80℃的目的是促进Fe3+水解,而又不至于Fe3+完全水解生成氢氧化铁胶体。
(6)双氧水在酸性环境(硫酸)中是一种强氧化剂,可以将硫酸亚铁氧化成三价铁,制得Fe2(OH)n(SO4)3-n/2。根据电子守恒和质量守恒定律可得反应的化学方程式为2FeSO4+H2O2+(1-n/2)H2SO4=Fe2(OH)n(SO4)3-n/2+(2-n)H2O。
本题难度:一般
3、简答题 现有浓度各为1mol?L-1的FeCl3、FeCl2、CuCl2混合溶液100mL,加入一定量的铁粉,对下列各情况填空(已知:氧化性Fe3+>Cu2+>Fe2+).
(1)反应完毕,铁粉有剩余.反应后的溶液中一定含______阳离子.
(2)反应完毕,有铜生成,铁粉无剩余.反应后的溶液中一定含______阳离子,该阳离子在溶液中物质的量的范围是______;反应后的溶液中可能含______阳离子.
(3)反应完毕后,无固体沉积物存在,反应后的溶液中一定含______和______阳离子.
参考答案:(1)由于铁粉有剩余,且氧化性Fe3+>Cu2+>Fe2+,所以溶液中Cu2+和Fe3+完全与铁粉反应,反应后溶液中只存在Fe2+,
故答案为:Fe2+;
(2)反应完毕,有铜生成,铁粉无剩余,溶液中的铁离子完全反应,铜离子可能完全反应,有可能部分反应,反应后的溶液中一定存在亚铁离子,可能含有铜离子;浓度各为1mol?L-1的FeCl3、FeCl2、CuCl2混合溶液100mL,溶液中FeCl3、FeCl2、CuCl2的物质的量均为0.1mol,若铁离子和亚铜离子恰好完全被铁粉还原,此时溶液中的亚铁离子的物质的量有最大值,根据反应:2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu,最大值为:n(Fe2+)=n原有(Fe2+)+n(Cu2+)+32n(Fe3+)=0.1mol+0.1mol+1.5mol=3.5mol;由于氧化性Fe3+>Cu2+>Fe2+,当铁离子被还原,铜离子刚开始反应,亚铁离子有最小值,n(Fe2+)=n原有(Fe2+)+32n(Fe3+)=0.1mol+1.5mol=2.5mol,由于有铜生成,所以溶液中铁离子一定大于2.5mol,亚铁离子在溶液中的范围为:0.25mol<n(Fe2+)≤0.35mol,
故答案为:Fe2+;0.25mol<n(Fe2+)≤0.35mol;Cu2+;
(3)反应完毕后,无固体沉积物存在,说明溶液中的铜离子没有参加反应,铁离子可能恰好反应,有可能有剩余,反应后的溶液中一定存在Fe2+和Cu2+,故答案为:Fe2+;Cu2+.
本题解析:
本题难度:简单
4、填空题 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与金属铜发生反应的化学方程式:______________________;
(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤
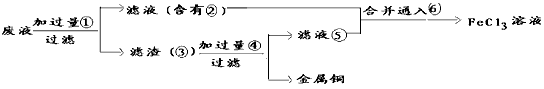
请写出上述实验中加入或生成的有关物质的化学式:③___________④_____________;
(3)写出向②⑤的混合液中通入⑥的离子方程式__________________________________;
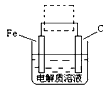
(4)钢铁的电化腐蚀简单示意图如下图,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。
(5)配制硫酸亚铁溶液时,常在其中加入____________,理由是________________________________。
(6)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是___________________________。
参考答案:(1)2FeCl3+Cu==2FeCl2+CuCl2?
(2)③ Fe、Cu;④ HC1
(3)2Fe2++Cl2==2Fe3++2Cl-
(4)
(5)铁屑和稀硫酸;防止Fe2+氧化成Fe3+,抑制Fe2+水解
(6)酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体
本题解析:
本题难度:困难
5、填空题 为15%、密度为1.31g/cm3的硫酸250mL(不含铁化合物或其它酸)跟过量的铁屑充分反应,计算:
(1)写出该反应的化学方程式_____________________
(2)制得氢气(标准状况)的体积____________
(3)把生成的硫酸亚铁配制成400mL溶液,这溶液的物质的量浓度是____________。
参考答案:(1)Fe+H2SO4==FeSO4+H2↑
(2)11.2L
(3)1.25mol/L
本题解析:
本题难度:一般