微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关纯铁的描述正确的是
[? ]
A.熔点比生铁的低
B.与相同浓度的盐酸反应生成氢气的速率比生铁的快
C.在潮湿空气中比生铁容易被腐蚀
D.在冷的浓硫酸中可钝化
参考答案:D
本题解析:
本题难度:简单
2、选择题 向一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入240mL?4mol/L的稀硝酸,恰好使混合物完全溶解.放出2.688L?NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现,若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为( )
A.0.42mol
B.0.21mol
C.0.16mol
D.0.14mol
参考答案:因一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入240mL?4mol/L的稀硝酸,恰好使混合物完全溶解,
所得溶液中加入KSCN溶液,无血红色出现,则溶液中的溶质为Fe(NO3)2,
2.688LNO(标准状况)的物质的量为2.688L22.4L/mol=0.12mol,
设混合物中铁原子的物质的量为x,由原子守恒可知,则
? 2HNO3~Fe(NO3)2~Fe
? ?2? 1
0.24L×4mol/L-0.12mol?x
21=0.24L×4mol/L-0.12molx,
解得x=0.42mol,
故选A.
本题解析:
本题难度:简单
3、选择题 把某表面被氧化的钢铁样品,加入过量稀H2SO4中,过滤,除去杂质,在滤中滴加KSCN溶液无血红色,继续向滤液中加入适量硝酸后,再加入过量的氨水,有沉淀生成.上述作过程中加入硝酸之前溶液中的溶质和最终生成的沉淀颜色分别为( )
A.Fe2(SO4)3;白色
B.Fe2(SO4)3;红褐色
C.FeSO4;红褐色
D.FeSO4;色→灰绿色→红褐色
参考答案:C
本题解析:
本题难度:一般
4、填空题 (10分)信息时代产生的大量电子垃圾对环境构成严重威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含Cu、Fe及少量Au、Pt等金属的混合物,并用如下流程制备胆矾晶体(CuSO4?5H2O):
 ?
?
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子
| Fe3+
| Fe2+
| Cu2+
|
开始沉淀
| 1.5
| 6.4
| 4.2
|
完全沉淀
| 3.2
| 8.9
| 6.7
|
(1)滤渣Ⅰ的主要成份是(写化学式)______。
(2)反应Ⅱ中加入H2O2的作用是______。
(3)沉淀过程中发生反应的离子方程式有______、______。
(4)操作Ⅰ的步骤是______、______、过滤、洗涤、干燥。
(5)测定胆矾晶体纯度的实验步骤如下:
a. 准确称取3.125g胆矾晶体样品配成100mL溶液;
b. 取10.00 mL溶液于带塞锥形瓶中,加适量水稀释,加入过量KI固体,发生反应:
2Cu2+ +4Iˉ=2CuI↓ + I2
c. 继续向上述混合物中,逐滴加入0.1000 mol·L-1Na2S2O3溶液至恰好完全反应,共消耗12. 00mL Na2S2O3溶液:I2+2S2O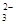 = 2Iˉ+S4O
= 2Iˉ+S4O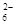
求样品中胆矾晶体的质量分数(写出计算过程)。
参考答案:(1)Au、Pt?(2)使Fe2+氧化为Fe3+
(3)H+ + OHˉ = H2O? Fe3+ + 3OHˉ= Fe(OH)3↓?
(4)蒸发浓缩?冷却结晶?
(5)96%(无计算过程不得分)
解:n(Na2S2O3) = 0.012L×0.1000mol·L-1=" 0.0012" mol
2CuSO4·5H2O~I2~2S2O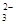
n(CuSO4·5H2O) = n(Na2S2O3) =" 0.0012" mol
m(CuSO4·5H2O) =" 0.0012" mol×250g·mol-1 = 0.30g?
w(胆矾) =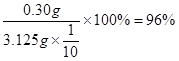
本题解析:⑴在金属混合物中只有Au、Pt不溶于硝酸,故滤渣Ⅰ的主要成份是Au、Pt。
⑵过滤I的滤液中含有Cu2+、Fe3+、Fe2+,根据这些阳离子以氢氧化物形式沉淀时溶液的pH可知,加入H2O2将Fe2+氧化为Fe3+,才能将铁转化为Fe(OH)3沉淀除去。
⑶在沉淀过程中加入NaOH,中和H+(H+ + OHˉ = H2O),提高pH使Fe3+转化Fe(OH)3沉淀(Fe3+ + 3OHˉ= Fe(OH)3↓)。
⑷过滤Ⅱ的滤液中含有CuSO4,通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得胆矾晶体。
⑸详见参考答案的解答过程
本题难度:一般
5、选择题 久置空气中会发生颜色变化,但颜色变化不是由于跟氧气反应引起的是
[? ]
A.过氧化钠固体
B.亚硫酸钠固体
C.硫酸亚铁晶体
D.苯酚晶体
参考答案:A
本题解析:
本题难度:简单