微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是( )
A.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+
B.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含有Cu2+和Fe3+
C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+
D.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+
参考答案:D
本题解析:由于先发生反应:Fe+2FeCl3=3FeCl2,后发生反应:Fe+CuCl2=FeCl2+Cu。若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含有Cu2+,一定不含Fe3+;若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+,故A、B、C项均错误,D项正确。
本题难度:一般
2、选择题 下列变化不能通过一步反应直接完成的是( )
A.Al→AlO2-
B.Na2CO3→NaOH
C.Al2O3→Al(OH)3
D.Fe(OH)2→Fe(OH)3
参考答案:C
本题解析:
本题难度:简单
3、填空题 现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。
某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
?
已知:①Cu2O+2H+=Cu2++Cu+H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混
合液浸出铜;③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1) 矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O、
?、?(任写其中2个)。
(2)“循环Ⅰ”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体
的化学式是?。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写
出水层1暴露在空气中发生反应的离子方程式?。
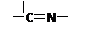 (3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分
(3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分
子结构中仅含n1个 —CH3、n2个 —OH 和n3个?三种基团,无环状结构,三种基团的数
目关系为n3=?。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,
则A的结构简式是?。
(4) 写出电解过程中阳极(惰性电极)发生反应的电极反应式:?。
(5)“循环Ⅲ”中反萃取剂的主要成分是?。
参考答案:(1) CuO+2H+==Cu2++H2O、Fe2O3+6H+==2Fe3++3H2O、Cu+2Fe3+==2Fe2++ Cu2+?
(2) FeSO4?7H2O ,4Fe2++O2+4H+==4Fe3+ +2H2O
(3) n3= (n1+n2-2)? CH3—C(=N-OH)—C(=N-OH)—CH3
(4) 4OH--4e-="=" O2+2H2O? (5) H2SO4
本题解析:本题看似考察酸浸法从矿石中提取铜这样一个复杂的工艺流程,实际上考察了常见金属及其化合物的性质(1、2两问)、电解精炼铜(4、5两问)及对有机物结构的体认(3) 。
(1)由矿石成分知氧化铜、氧化铁与硫酸反应。

 (2)因有铜单质析出,故不能存在亚铁离子,且亚铁离子的强还原性易被氧化为铁离子。
(2)因有铜单质析出,故不能存在亚铁离子,且亚铁离子的强还原性易被氧化为铁离子。
(3)—CH3、 —OH是端头基。?是分子的骨架,一个?就需多一个端头基,加上链首尾的两个端头基,共需端头基n3+2,即n3+2=n1+n2。
(4) 电解精炼铜,阳极放电离子是OH-。
(5)由电解精炼铜知生成硫酸,反萃取剂是硫酸。
本题难度:一般
4、选择题 除去铜粉中的氧化铜,方法正确的是

A.在空气中加热
B.加入足量的水,充分搅拌后过滤

C.加入足量的NaOH溶液,充分反应后过滤
D.加入足量的盐酸,充分反应后过滤
参考答案:D
本题解析:铜的活泼性在H之后,不溶于酸,而CuO为碱性氧化物,可溶于酸,故用稀盐酸溶解,过滤即可以除去。
本题难度:简单
5、实验题 三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是_____________________________________________。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?________。简述你的理由(不需写出反应方程式)____________
________________________________________________________________________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是________,写出发生反应的离子方程式________________________________。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数,取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为________。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
物质
| Cu(OH)2
| Fe(OH)2
| Fe(OH)3
|
开始沉淀pH
| 6.0
| 7.5
| 1.4
|
沉淀完全pH
| 13
| 14
| 3.7
|
?
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
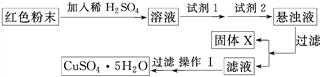
试回答:
①试剂1为________(填字母,后同),试剂2为________。
②固体X的化学式为____________________________________________________。
③操作Ⅰ为___________________________________________________________。
参考答案:(1)溶液变为血红色
(2)不合理 Cu能将Fe3+还原为Fe2+
(3)Fe2O3和Cu2O的混合物
Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+
(4) 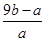 ×100%
×100%
(5)①B D ②Fe(OH)3 ③加热蒸发
本题解析:(1)若假设1成立,则溶液中含有Fe3+,遇到KSCN溶液显红色。(2)如果混合物中含有Cu2O,遇到酸产生Cu,Cu能与Fe3+反应生成Fe2+和Cu2+,故此种说法不正确。(3)若固体全部溶解,则一定存在Fe2O3和Cu2O,因为Cu2O溶于硫酸生成Cu和CuSO4,而H2SO4不能溶解Cu,所以混合物中必须有Fe2O3存在,使其生成的Fe3+溶解产生的Cu。(4)依据题意,能发生反应的物质为Cu2O,最后变成CuO,增加的质量就是反应的氧气的质量,根据质量差计算可以得出Cu2O的质量分数。(5)根据题给表格可知,Fe(OH)3完全沉淀时,pH最小,故应将Fe2+先转化为Fe3+,再利用增大pH的方法除去溶液中的Fe3+,但是所加物质不能增加新的杂质,故第一步氧化剂应是H2O2,再加入Cu2(OH)2CO3,调节pH,使溶液中的Fe3+生成沉淀除去。
本题难度:一般