微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (1)某学习小组利用下图装置制取氯气并探究其性质。
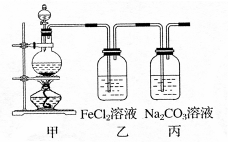
①甲装置中反应的化学方程式是?;
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象)?;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是?。
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol·L-1盐酸、品红溶液、新制澄清石灰水。
【提出假设】假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含?;
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3 。
【进行实验】在答题卡上完成下表(不必检验Ca2+、Cl-):
实验步骤
| 预期现象和结论
|
①
| 用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管?
?
?
| 若无气体放出且澄清石灰水未见浑浊,则假设一成立;?
?
?
|
②
| ?
?
?
| ?
?
?
|
?
参考答案:(14分)
(1)①MnO2+4HCl (浓)  MnCl2+ Cl2↑+2H2O (2分)
MnCl2+ Cl2↑+2H2O (2分)
②KSCN溶液(1分);溶液变红色(1分)[或NaOH溶液,红褐色沉淀等合理答案均给分];
③Cl2+2H2O+Na2CO3=" NaCl+" NaCl+2NaHCO3(2分)
(2)CaCO3、CaCl2(2分)
(3)10-8/(a-0.1) (2分)
实验步骤
预期现象和结论
①
加入适量1mol/L-1盐酸(1分),塞上带导管的单孔塞,将导管另一端插入A试管中(1分)
若有气体放出且澄清石灰水未见浑浊,则假设二或三成立[或假设三不成立] (1分)
②
用胶头滴管向上述步骤后的B试管中滴入几滴品红溶液,震荡(1分)[或另取少量样品于试管中,滴入几滴蒸馏水震荡,再滴入品红溶液]
若品红不褪色,则假设二成立(1分);若品红褪色,假设三成立(1分)
本题解析:
(1)①实验室制取氯气的反应:MnO2+4HCl (浓)  MnCl2+ Cl2↑+2H2O。②FeCl2溶液与Cl2发生氧化还原反应生成三价铁离子,加入KSCN溶液,溶液变红色。③由题意得:Cl2+2H2O+Na2CO3=" NaCl+" NaCl+2NaHCO3。
MnCl2+ Cl2↑+2H2O。②FeCl2溶液与Cl2发生氧化还原反应生成三价铁离子,加入KSCN溶液,溶液变红色。③由题意得:Cl2+2H2O+Na2CO3=" NaCl+" NaCl+2NaHCO3。
(2)漂白粉主要成分CaCl2、Ca(ClO)2,Ca(ClO)2变质会生成CaCO3。提出假设二:该漂白粉全部变质,含CaCO3、CaCl2。根据假设可知检测CaCO3的实验方案。
本题难度:一般
2、简答题 某校学生课外活动小组的同学设计如下图所示实验装置,用来验证一氧化碳具有还原性.回答下列问题:

(1)装置B中最适宜的试剂是______,其作用是______
(2)装置C的作用是______,若实验中没有装置C,则不可以证明CO具有还原性,原因是:______
(3)装置D中黑色固体为______,反应的化学方程式为______
(4)根据实验中的______现象,可证明CO具有还原性,有关反应的化学方程式是______
(5)若要根据装置F中出现的现象确认一氧化碳具有还原性,应在上图装置______与______之间连接图中的______装置(填序号).
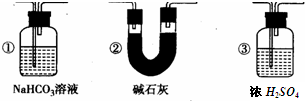
参考答案:(1)实验室用盐酸和石灰石制取二氧化碳,该反应放出的热量导致盐酸挥发,所以制取的二氧化碳中含有氯化氢气体,为除去氯化氢气体,选取的试剂应能除去氯化氢气体且不和二氧化碳反应,则只能选取可溶性的饱和碳酸氢盐,一般
常用饱和的碳酸氢钠溶液,故答案为:饱和碳酸氢钠溶液,除去CO2混有的HCl;
(2)浓硫酸具有吸水性,且和二氧化碳不反应,所以能干燥二氧化碳;若实验中没有装置C,从B装置出来的气体中含有水蒸气,碳和水蒸气反应生成的氢气也能还原氧化铜,从而造成干扰,
故答案为:干燥CO2,C和H2O反应生成的H2也能还原氧化铜;
(3)高温条件下,二氧化碳和碳反应生成一氧化碳,所以D装置中的黑色固体是碳,反应方程式为:CO2+C?高温?.?2CO,
故答案为:C,CO2+C?高温?.?2CO;
(4)一氧化碳具有还原性,所以能还原黑色的氧化铜,使其变为红色的铜单质,所以E中的现象是:黑色固体变为红色,反应方程式为:CO+CuO?△?.?Cu+CO2,
故答案为:E中黑色固体变红,CO+CuO?△?.?Cu+CO2;?
(5)和二氧化碳的反应中,二氧化碳不可能完全转化为一氧化碳,所以从D装置出来的气体中含有二氧化碳,为防止原来二氧化碳的干扰,应先把D出来的二氧化碳除去,再将一氧化碳气体通过E装置,二氧化碳是酸性氧化物,所以用碱性物质除去,所以选②,故答案为:D、E,②.
本题解析:
本题难度:一般
3、实验题 (10分)配制500mL 0.5mol/L的NaOH溶液,试回答下列问题。
(1)需要NaOH固体的质量为?。
(2)某同学用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将?(填“高于”或“低于”)右边的托盘,欲使天平平衡,所进行的操作应?。假定最终称得小烧杯的质量为?(填“32.6g”或“32.61g”)。
(3)配制方法:设计了如下五个操作步骤,正确的顺序是?。
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温。
②继续往容量瓶中加蒸馏水至液面距刻度线1c m~2cm。
m~2cm。
③将NaOH溶液沿玻璃棒注入500mL容量瓶中。
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移 入容量
入容量 瓶。
瓶。
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
(4)某学生实际配制NaOH溶液的浓度为0.48mol/L,原因可能是(?)
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解用的烧杯未经多次洗涤
D.用胶头滴管加水定容时仰视刻度线
参考答案:(10分)
(1) 10.0g (2分)?
(2) 高于?将左边的平衡螺母左旋(或将右边螺母左旋)直至天平平衡? 32.6g (3分)
(3) ①③④②⑤(顺序全对2分)?
(4) A? C? D (3分)
本题解析:略
本题难度:一般
4、实验题 已知浓硫酸具有强氧化性,可与炭粉反应。
(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式:___________________
(2)试用如图所示装置设计一个实验来验证上述反应所产生的各种产物。这些装置的连接顺序是
_____→_____→______→_______(填编号)。

(3)装置②中所加固体药品是____,可确定的产物是____。确定装置②在整套装置中的位置,理由是____________________。
(4)③中所盛溶液是____,可验证的产物是___。
参考答案:(1)C+2H2SO4(浓) 2SO2↑+CO2↑+2H2O
2SO2↑+CO2↑+2H2O
(2)④;②;①;③
(3)无水CuSO4;水蒸气;由于产物气流通过①、③时会带出水蒸气,所以②必须在①、③之前
(4)澄清石灰水;CO2
本题解析:
本题难度:一般
5、实验题 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略。 将封闭有甲烷和氯气的混和气体的装置放置在有光亮的地方,让混和气体缓慢的反应一段时间。
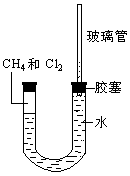
(1)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式:______________________。
(2)经过几个小时的反应后,U型管右端的玻璃管中水柱变化是________________。
A.升高 B.降低 C.不变 D.无法确定
(3)U型管左端的气柱变化是________________。
A.体积增大 B.体积减小 C.消失 D.不变
(4)试解释U型管右端的玻璃管中水柱变化的原因:______________________________。
参考答案:(1)CH4+4Cl2 CCl4+4HCl
CCl4+4HCl
(2)B
(3)C
(4)由上述化学方程式可知,此反应中气体的物质的量减少,且生成的HCl能够溶解于水,所以U型管左侧压强减小至零,故右侧玻璃管中的水柱降低,左侧气柱消失
本题解析:
本题难度:一般