|
|
|
高中化学知识点大全《化学平衡常数》考点巩固(2017年最新版)(二)
2017-08-06 08:51:14
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知反应aA(g)+bB(g)?cC(g)+dD(g),如图表示在不同条件下反应物D的体积分数φ(D)随时间变化的关系,据此判断( ) 
A.a+b<c+d;△H<0
B.a+b<c+d;△H>0
C.a+b>c+d;△H>0
D.a+b>c+d;△H<0
|
参考答案:C
本题解析:
本题难度:简单
2、简答题 已知化学反应①:Fe(s)+CO2(g)=FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)=FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2
973K
1.47
2.38
1173K
2.15
1.67
|
(1)通常表格中的数值可以推断:反应①是______(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)=CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=______.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式______.据此关系式及上表数据,也能推断出反应③是______(填“吸热”或“放热”)反应,要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______(填写序号).
A.缩小反应容器容积?B.扩大反应容器容积?C.降低温度?D.升高温度
E.使用合适的催化剂?F.设法减少CO的浓度.
参考答案:(1)由表中数据可知,温度升高,①的平衡常数增大,说明平衡向正反应方向移动,则正反应吸热,
故答案为:吸热;
(2)依据反应CO2(g)+H2(g)=CO(g)+H2O(g),根据平衡常数的概念,该反应的平衡常数K3的数学表达式:K=[CO][H2O][H2][CO2],故答案为:[CO][H2O][H2][CO2];
(3)已知:①Fe(s)+CO2(g)?FeO(s)+CO(g);
②Fe(s)+H2O(g)?FeO(s)+H2(g);
利用盖斯定律将①-②可得:③H2(g)+CO2(g)?CO(g)+H2O(g);
则K3=c(CO)c(H2O)c(H2)c(CO2)=c(CO)c(CO2)c(H2)c(H2O)=K1K2;
依据图表平衡常数数据分析,温度升高K1K2增大,说明平衡正向进行,反应是吸热反应;
③H2(g)+CO2(g)?CO(g)+H2O(g)反应是吸热反应,反应前后气体体积不变,要使反应在一定条件下建立的平衡向正反应方向移动,则
A.缩小反应容器容积实质增大压强,反应前后气体体积不变,平衡不动;?故A不符合;?
B.扩大反应容器容积,压强减小,反应前后气体体积不变,平衡不动;故B不符合;?
C.反应是吸热反应,降低温度,平衡向放热反应方向进行,平衡逆向进行,故C不符合;?
D.反应是吸热反应,升高温度,平衡向吸热反应方向进行,平衡正向进行,故D符合;
E.使用合适的催化剂,催化剂只改变反应速率,不改变平衡,故E不符合;
F.设法减少CO的浓度,减少生成物浓度平衡正向进行,故F符合;
故答案为:K1K2;吸热;DF.
本题解析:
本题难度:一般
3、选择题 下列对化学反应限度的叙述中错误的是
[? ]
A.任何可逆反应在给定条件下都有一定的限度
B.化学反应达到限度时,正、逆反应速率相等
C.化学反应的限度与时间的长短无关
D.化学反应的限度不随外界条件的改变而改变
参考答案:D
本题解析:
本题难度:简单
4、选择题 可逆反应2A(g)+B(g)?2C(g),根据下表中的数据判断下列图象错误的是( )
| 压强A转化率温度 | p1(MPa) | p2(MPa)
400℃
99.6
99.7
500℃
96.9
97.8
|
A.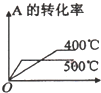
B.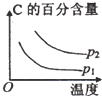
C.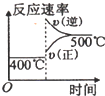
D.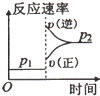
参考答案:由表中数据可知,在相同压强下,升高温度,A的转化率降低,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,在相同温度下,增大压强,A的转化率增大,说明平衡向正反应方向移动,则
A.升高温度,A的转化率降低,与表中数据吻合,故A正确;
B.升高温度,平衡向逆反应方向移动,C的百分含量降低,增大压强,平衡向正反应方向移动,C的百分含量增大,与表中数据吻合,故B正确;
C.升高,反应速率增大,平衡向逆反应方向移动,逆反应速率大于正反应速率,与表中数据吻合,故C正确;
D.增大压强,反应速率增大,正反应速率大于逆反应速率平衡向正反应方向移动,图象与表中数据不吻合,故D错误.
故选D.
本题解析:
本题难度:简单
5、选择题 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
|
| 容器 | 甲 | 乙 | 丙
容积
0,5L
0,5L
1,0L
温度/℃
T1
T2
T2
反应物
起始量
1,5molA
0,5molB
1,5molA
0,5molB
6,0molA
2,0molB
|
下列说法正确的是( )
A.10min内甲容器中反应的平均速率v(A)=0.025mol/(L?min)
B.由图可知:T1<T2,且该反应为放热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%

参考答案:BC
本题解析:
本题难度:一般




