微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 mA(气)+nB(气)?pC(气)+qD(气)的C%与时间t有如图关系
(1)若E、F表示两种温度,则E______F(填>、<或=),正反应______热
(2)若E、F表示两种压强,则m+n______p+q.
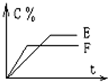
参考答案:(1)F曲线到达平衡时间短,速率快,所以温度高,即温度E<F;升高温度,C%减小,平衡逆移,所以正方向为放热反应,故答案为:<;放;
(2)F曲线到达平衡时间短,速率快,所以压强大;增大压强,C%减小,平衡逆移,正方向为体积增大的方向,所以m+n<p+q,故答案为:<;
本题解析:
本题难度:一般
2、填空题 化学平衡常数K表示可逆反应的进行程度,K值越大,表示____,K值大小与温度的关系是温度升高,K值____(填“一定增大”“一定减小”或“可能增大也可能减小”)。
参考答案:可逆反应进行的程度越大 ;可能增大也可能减小
本题解析:
本题难度:一般
3、填空题 有体积相等的甲、乙两个密闭容器,如图1所示,甲的活塞可以随意推拉,乙为恒容.向甲容器中充入等物质的量的气体A和B,一定温度下发生反应,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时问变化的曲线如图2所示.
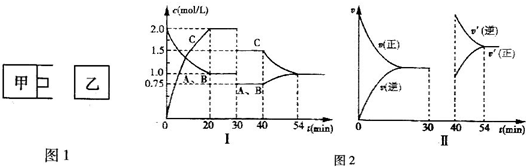
(1)0~20min?A的平均反应速率为______.
(2)①30min时改变了一种反应条件,所改变的条件和判断的理由是______;②已知该反应的正反应为放热反应,40min时改变了一种反应条件,所改变的条件和判断的理由是______.
(3)请在图2的Ⅱ图中补画出30~40min正、逆反应速率关于时间变化的曲线.
(4)若向乙容器中充入一定量的A、B、C,使A、B起始浓度均为a?mol/L,C为3.5mol/L,一定温度下达到平衡时,C的浓度为2.0mol/L,则a=______.
参考答案:(1)0~20?min内A的浓度减少了1mol/L,故v(A)=1mol/L20min=0.05mol/(L?min),故答案为:0.05mol/(L?min);
(2)①由图象可知,30min时正、逆反应速率降低,A、C的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,A的浓度由1mol/L变为0.75mol/L,故增大体积为原来的43倍,
故答案为:增大体积为原来的43倍;30min时正、逆反应速率降低,A、C的浓度瞬时降低,反应仍处于平衡状态,A的浓度由1mol/L变为0.75mol/L;
②由图可知,40min时改变的条件,瞬间A、C的浓度不变,正、逆速率都增大,平衡向逆反应移动,应为升高温度,
故答案为:升高温度;40min时改变的条件,瞬间A、C的浓度不变,正、逆速率都增大,平衡向逆反应移动;
(3)30~40?min改变的条件是降低压强,平衡不移动,故图象为
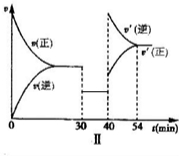
,
故答案为:

;
(4)由图Ⅰ可知,20minA、B、C的浓度变化量分别为1mol/L、1mol/L、2mol/L,据此可知方程式为:A(g)+B(g)?2C(g),反应前后气体的体积不变,平衡时甲、乙两容器内C的浓度都是2mol/L,为完全等效平衡,按化学计量数转化到左边,满足c(A)=c(B)=2mol/L,故c(A)+12c(C)=2mol/L,即a+12×3.5mol/L=2mol/L,解得a=0.25,
故答案为:0.25.
本题解析:
本题难度:一般
4、简答题 (1)研究硫及其化合物性质有重要意义.
硫酸工业生产中涉及如下反应:2SO2(g)+O2(g)═2SO3(g).向2L的容器中充入2mol SO2、1mol O2,SO2的平衡转化率与温度的关系如图所示.T1温度时反应进行到状态D时,v(正)______v(逆)(填“>”、“<”或“=”).温度为T1时,反应的平衡常数K=______.(单位必须写),若在T3温度时,达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2并使之重新达到平衡,测得又放出热量Q2.则下列说法正确的是______.(填字母编号)
a.容器的压强增大原来的两倍b.Q2一定等于Q1
c.新平衡时SO2的转化率一定大于80% d.T3时的平衡常数大于T1时的平衡常数
(2)已知:25℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp(MgF2)=7.4×10-11.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)______(填增大、减小或不变);在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是______(写化学式).
(3)Al2(SO4)3溶液显示酸性,其原因是______(写离子方程式),向某酸化的Al2(SO4)3溶液中加入NaHCO3固体,出现的现象是:有大量气体产生,同时有白色沉淀,试用平衡移动原理解释原因:______.
(4)加热蒸发下列溶液,能析出得到原溶质的是______.
a.KNO3溶液b.AlCl3溶液c.Al2(SO4)3溶液d.盐酸
(5)25℃时,pH为4的氯化铵溶液和pH为4盐酸溶液中,由水电离出的H+浓度之比为______.
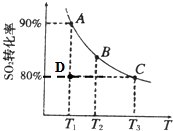
参考答案:(1)温度T1时,平衡点为A,D点二氧化硫转化率小于A,反应向正方向进行,V正>V逆,
转化的二氧化硫的物质的量:2mol×90%=1.8mol
2SO2(g)+O2(g)═2SO3(g)
起始浓度 1mol/L 0.5mol/L 0
转化浓度 0.9mol/L 0.45mol/L 0.9mol/L
平衡浓度 0.1mol/L 0.05mol/L 0.9mol/L K=[SO3]2[SO2]2[O2]=1620L/mol,故答案为:1620L/mol;
T3时,若再向容器中加入2mol SO2、1mol O2,若平衡不移动压强变为原来的2倍,但是该反应前后气体系数不同,加入2mol SO2、1mol O2,相当增大压强平衡向正方向移动,故a错误;达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2,相当于原容器加压,平衡向正反应方向移动,所以放出的热量增大,故Q2>Q1,故b错误;平衡向正反应方向移动,反应物的转化率增大,故c正确;正反应为放热反应,升高温度K减小,故d错误,故选c,
故答案为:>;1620L/mol;c;
(2)根据Mg(OH)2沉淀溶解平衡Mg(OH)2 (s)Mg2+(aq)+2OH- (aq),加入氯化铵,NH4+消耗氢氧根使平衡右移,镁离子浓度增大;故答案为:增大;
氢氧化镁与氟化镁,结构相同,Ksp[Mg(OH)2]=5.6×10-12,Ksp(MgF2)=7.4×10-11,二者氢氧化镁溶解度更小,先沉淀,故答案为:Mg(OH)2;
故答案为:增大;Mg(OH)2;所以溶液显酸性;
(3)Al2(SO4)3是强酸弱碱盐,铝离子水Al3++3H2O Al(OH)3+3H+所以溶液显酸性,加入碳酸氢钠后,碳酸氢根离子发生水HCO3-+H2O H2CO3+OH-,水解生成的氢氧根离子与铝离子水解生成的氢离子反应,双方相互促进,发生双水解,所以有大量气体产生,同时有白色沉淀,
故答案为:Al3++3H2O?Al(OH)3+3H+;铝离子和碳酸氢根离子发生双水解,相互促进,使水解平衡向正方向进行;
(4)a.硝酸钾溶液中不存在水解物质,蒸干水后得到硝酸钾固体,故a正确;
b.AlCl3水解生成氢氧化铝和氯化氢,加热氯化氢易挥发,促进水解平衡向右移动,所以整个该溶液得到的是氢氧化铝固体,故b错误;
c.Al2(SO4)3虽然水解但是生产的硫酸是难挥发性酸,蒸干溶液得到仍然是硫酸铝固体,故c正确;
d.盐酸是挥发性酸,加热促进氯化氢的挥发,蒸干后得不到原溶质,故d错误;
故选ac;
(5)pH=4的氯化铵溶液中,水电离的氢离子浓度:C(H+)=10-4mol/L,pH=4的盐酸溶液中,水电离的氢离子的浓度:C(H+)′=10-10mol/L,C(H+):C(H+)′=106(或 106:1),故答案为:106(或 106:1).
本题解析:
本题难度:一般
5、填空题 (1)甲醇是一种可再生能源,工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)

CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g)

CH3OH(g)+H2O(g)
反应Ⅲ:甲醇燃烧2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)
上述反应符合“原子经济”原则的是______(填“Ⅰ”或“Ⅱ”).
(2)依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应为______.
②工作一段时间后,测验得溶液的pH减小,该电池总反应的
化学方式式为______.
(3)甲烷也是一种可再生的能源,如果用甲烷来制水煤气,反应方程式为:
CH4(g)+H2O(g)

CO(g)+3H2(g)
△H═+206kJ/mol
在一体积恒定为1L的密闭器中用1mol甲烷和1mol水蒸气进行以上反应,测得甲烷的物质的量浓度随反应时间的变化如图所示.
①反应在0~5min这段时间共吸收的热量为______kJ;
②进行到5min时,反应达到平衡,这时平衡常数K的数值为______;
③进行到8min时,只改变了影响平衡的一个条件:水蒸气的浓度.10min达到新的平衡,这时c(H2O)=______mol/L.(小数点后面保留一位数)

参考答案:(1)化合反应的原子利用率最高,为100%,故答案为:Ⅰ;
(2)甲醇燃烧的反应原理是:正极反应一定是氧气得电子的过程,在碱性环境下,得到氢氧根离子,即O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②所有燃料电池的总反应是燃料的燃烧反应,溶液的pH减小,说明电解质氢氧化钾被消耗,即2CH3OH+3O2+4OH-=2CO32-+6H2O,故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
(3)①0~5min这段时间所消耗的甲烷的浓度为0.5mol/L,根据热化学方程式CH4(g)+H2O(g)

CO(g)+3H2(g),△H═+206kJ/mol的含义,所以消耗的甲烷的浓度为0.5mol/L时,吸收的热量为:12×206kJ=103KJ,故答案为:103;
②进行到5min钟时,甲烷的浓度为0.5mol/L,所以水蒸气以及一氧化碳的浓度为0.5mol/L,氢气的为1.5mol/L,据K=[CO][?H2]3[CH4]?[H2O]=0.5×1.530.5×0.5=6.75(mol/L)2,故答案为:6.75;
③当反应进行到8min时,甲烷的浓度减小,所以是增加了水蒸气的量,设加入的水蒸气的量为x,则:
? ?CH4(g)+H2O(g)

CO(g)+3H2(g)
初始浓度:1? 1? 0? 0
变化浓度:0.75? 0.75? 0.75? 2.25
8min钟末浓度:0.25? 1+x-0.75? 0.75? 2.25
则Qc=0.75×2.2530.25×(1+x-0.75)=6.75
解得x=4.8125,所以8min时c(H2O)=4.8125+0.25=5.0625≈5.1(mol/L).
故答案为:5.1.
本题解析:
本题难度:简单