微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
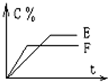
1、填空题 mA(气)+nB(气)?pC(气)+qD(气)的C%与时间t有如图关系
(1)若E、F表示两种温度,则E______F(填>、<或=),正反应______热
(2)若E、F表示两种压强,则m+n______p+q.
2、填空题 化学平衡常数K表示可逆反应的进行程度,K值越大,表示____,K值大小与温度的关系是温度升高,K值____(填“一定增大”“一定减小”或“可能增大也可能减小”)。
3、填空题 有体积相等的甲、乙两个密闭容器,如图1所示,甲的活塞可以随意推拉,乙为恒容.向甲容器中充入等物质的量的气体A和B,一定温度下发生反应,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时问变化的曲线如图2所示.
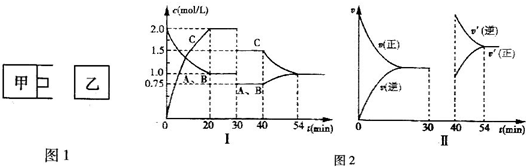
(1)0~20min?A的平均反应速率为______.
(2)①30min时改变了一种反应条件,所改变的条件和判断的理由是______;②已知该反应的正反应为放热反应,40min时改变了一种反应条件,所改变的条件和判断的理由是______.
(3)请在图2的Ⅱ图中补画出30~40min正、逆反应速率关于时间变化的曲线.
(4)若向乙容器中充入一定量的A、B、C,使A、B起始浓度均为a?mol/L,C为3.5mol/L,一定温度下达到平衡时,C的浓度为2.0mol/L,则a=______.
4、简答题 (1)研究硫及其化合物性质有重要意义.
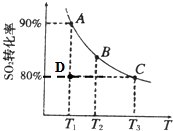
硫酸工业生产中涉及如下反应:2SO2(g)+O2(g)═2SO3(g).向2L的容器中充入2mol SO2、1mol O2,SO2的平衡转化率与温度的关系如图所示.T1温度时反应进行到状态D时,v(正)______v(逆)(填“>”、“<”或“=”).温度为T1时,反应的平衡常数K=______.(单位必须写),若在T3温度时,达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2并使之重新达到平衡,测得又放出热量Q2.则下列说法正确的是______.(填字母编号)
a.容器的压强增大原来的两倍b.Q2一定等于Q1
c.新平衡时SO2的转化率一定大于80% d.T3时的平衡常数大于T1时的平衡常数
(2)已知:25℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp(MgF2)=7.4×10-11.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)______(填增大、减小或不变);在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是______(写化学式).
(3)Al2(SO4)3溶液显示酸性,其原因是______(写离子方程式),向某酸化的Al2(SO4)3溶液中加入NaHCO3固体,出现的现象是:有大量气体产生,同时有白色沉淀,试用平衡移动原理解释原因:______.
(4)加热蒸发下列溶液,能析出得到原溶质的是______.
a.KNO3溶液b.AlCl3溶液c.Al2(SO4)3溶液d.盐酸
(5)25℃时,pH为4的氯化铵溶液和pH为4盐酸溶液中,由水电离出的H+浓度之比为______.
5、填空题 (1)甲醇是一种可再生能源,工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)

CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g)

CH3OH(g)+H2O(g)
反应Ⅲ:甲醇燃烧2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)
上述反应符合“原子经济”原则的是______(填“Ⅰ”或“Ⅱ”).
(2)依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应为______.
②工作一段时间后,测验得溶液的pH减小,该电池总反应的
化学方式式为______.
(3)甲烷也是一种可再生的能源,如果用甲烷来制水煤气,反应方程式为:
CH4(g)+H2O(g)

CO(g)+3H2(g)
△H═+206kJ/mol
在一体积恒定为1L的密闭器中用1mol甲烷和1mol水蒸气进行以上反应,测得甲烷的物质的量浓度随反应时间的变化如图所示.
①反应在0~5min这段时间共吸收的热量为______kJ;
②进行到5min时,反应达到平衡,这时平衡常数K的数值为______;
③进行到8min时,只改变了影响平衡的一个条件:水蒸气的浓度.10min达到新的平衡,这时c(H2O)=______mol/L.(小数点后面保留一位数)
