微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,在容积不变的密闭容器中充入l?mol?N2和3mol?H2,发生合成氨反应,t分钟后达到平衡状态.下列有关说法正确的是( )
A.达到化学平衡状态时,容器中将生成2molNH3
B.t分钟后,只要条件不变,容器内各气体的浓度就不再变化
C.达到化学平衡状态时,v(N2)=v(H2)=v(NH3)
D.达到化学平衡状态时,正反应和逆反应的速率相等,且均等于0
参考答案:A.反应为可逆反应,反应物的转化率不可能达到100%,所以生成的NH3的物质的量小于2mol,故A错误;
B.当反应达到平衡状态时,各物质的浓度不变,故B正确;
C.v(N2)=v(H2)=v(NH3),正逆反应速率不相等,没有达到平衡状态,故C错误;
D.达到化学平衡状态时,正反应和逆反应的速率相等,但不等于零,故D错误.
故选B.
本题解析:
本题难度:一般
2、计算题  (Ⅰ)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)
(Ⅰ)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)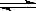 2NH3(g),其部分工艺流程如下:
2NH3(g),其部分工艺流程如下:






 回答下列问题:
回答下列问题:
 ⑴已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ/mol
⑴已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ/mol
 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=-905kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=-905kJ/mol
 2H2(g)+O2(g)=2H2O(g) ;△H=-483.6kJ/mol
2H2(g)+O2(g)=2H2O(g) ;△H=-483.6kJ/mol
 则N2(g)+3H2(g)
则N2(g)+3H2(g)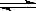 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。


 (2)假如该厂生产的氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH_________14-a,此时c(NH4+)________c(Cl-)(填“大于”“小于”或“等于”)。
(2)假如该厂生产的氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH_________14-a,此时c(NH4+)________c(Cl-)(填“大于”“小于”或“等于”)。
Ⅱ:(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa
时,16.0gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ, 写出表示N2H4燃烧热的热化学方程式是?。
写出表示N2H4燃烧热的热化学方程式是?。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。肼—空气燃料电池放电时:
正极的电极反应式是?。负极的电极反应式?。
(3)右图是一个电化学过程示意图。
①锌片上发生的电极反应是?。
②假设使用肼—空气燃料电池作为本过程中的电源,
铜片的质量变化128g,则肼一空气燃料电池理论
上消耗标准状况下的空气??L
(假设空气中氧气体积含量为20%)
参考答案:
(Ⅰ)
 (1)-92.4kJ/mol
(1)-92.4kJ/mol
(2)小于 ?等于
?等于
?
Ⅱ:(1) N2H4(l)+O2(g)=N2(g)+H2O(l);△H="-624kJ/mol?"
(2)? O2+4e-+2H2O=4OH-?, N2H4-4e-+4OH-=N2↑+4H2O?
(3)? Cu2+ + 2e -=" Cu?" ,? 112
本题解析:
(Ⅰ)根据盖斯定律可得:热化学反应方程式N2(g)+3H2(g)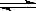 2NH3(g)的△H=180.5kJ/mol+[-(-905kJ/mol×1/2)]+[-483.6kJ/mol×3/2]=-92.4kJ/mol
2NH3(g)的△H=180.5kJ/mol+[-(-905kJ/mol×1/2)]+[-483.6kJ/mol×3/2]=-92.4kJ/mol
(2)当盐酸的pH=14-a时,它与等体积的氨水发生中和反应,溶液一定呈碱性,因氨水的量明显要过剩。现在要求二者中和反应后,混合液呈现中性,则盐酸的浓度要大一点,故溶液的PH小于14-a;根据电荷守恒可知。c(H+)+c(NH4+)=c(OH-)+c(Cl-),现溶液呈中性,故c(H+)=c(OH-),得c(Cl-)=c(NH4+)。
(Ⅱ)(1)由16.0gN2H4完全燃烧放出热量312kJ,可求出1mol肼完全燃烧所放出的热量为624k,故表示它的燃烧热的热化学方程式为N2H4(l)+O2(g)=N2(g)+H2O(l);△H="-624kJ/mol"
(2)由肼—空气燃料电池是一种碱性燃料电池可知,正极反应为 O2+4e-+2H2O=4OH-,负极反应可用总电极反应式减去正极反应式(电量守恒时),可得负极反应式为 N2H4-4e-+4OH-=N2↑+4H2O 。
(3)铜的质量变化为128g,由Cu-2e-=Cu2+,可知在电路中通过的电量为128g/64g.mol-1×2=4mole-,根据电量守恒,现电量由反应式 N2H4(l)+O2(g)=N2(g)+H2O(l)提供,故可得消耗1molO2(g),空气为5V(O2)=5×22.4L=112L。
本题难度:一般
3、填空题 一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应:? 3A(g)+B (g) xC(g)。若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。请填写下列空白:
xC(g)。若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。请填写下列空白:
(1) x=?;?1min内,B的平均反应速率为_________;
(2)若反应经2min达到平衡,平衡时C的浓度_________0.8mol/L(填“大于”、“等于”或“小于”);
(3)平衡混合物中,C的体积分数为22%,若维持容器压强不变,达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
(4)若改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n (B)、n(C)之间应满足的关系式__________________ 。
参考答案:(1)2?0.2 mol/(L·min);?(2) 小于
(3)大于?(4)n(A)+3n(C)/2=3? n(B)+ n(C)/2=1。
本题解析:
3A(g) + B (g)? xC(g)
xC(g)
起始? 3? 1? 0
转化? 1.2? 0.4?0.4×2=0.8
1min? 1.8? 0.6
所以x=2? B的平均反应速率为0.2 mol/(L·min)
(2)1min是C的浓度为0.4mol/L,2min平衡时随反应浓度降低,反应速率减慢,因此C的浓度小于0.8 mol/L。
(3)若维持容器压强不变,需要缩小容器体积,有利于反应正向移动,因此C的体积分数大于22%。
(4)根据等效平衡原理,需要满足:n(A)+3n(C)/2=3? n(B)+ n(C)/2=1。
本题难度:一般
4、选择题 对于反应2SO2+O2 2SO3,下列判断中正确的是
2SO3,下列判断中正确的是
[? ]
A.2体积SO2和足量O2反应,必定生成2体积SO3
B.其他条件不变,增大压强,平衡必定向右移动
C.平衡时,SO2消耗速度必定等于O2生成速率的两倍
D.平衡时,SO2浓度必定等于O2浓度的两倍
参考答案:B
本题解析:
本题难度:一般
5、选择题 向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O (g) CO2 +H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
CO2 +H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
A.0.5molCO+2molH2O(g)+1molCO2+1molH2
B.1molCO+1molH2O(g)+1molCO2+1molH2
C.0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
D.0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2
参考答案:B
本题解析:先用极值法,将CO2,H2全部转化为CO,H2O
A、 CO+H2O(g)  CO2+H2
CO2+H2
n起? 0.5? 2? 1? 1
n变? 1? 1? 1? 1
n终? 1.5? 3? 0? 0
所以相当于加入了1.5mol CO,和加入3molH2O,?增大了相同倍数,所以平衡不移动,CO的体积分数不变
B 、CO+H2O(g)  CO2+H2
CO2+H2
n起? 1? 1? 1? 1
n变? 1? 1? 1? 1
n终? 2? 2? 0? 0
所以相当于加入了2mol CO,和加入2molH2O ,?相当增大了CO的浓度,所以平衡正向移动,所以CO的转化率增大了,但转化的CO的量少过加入CO的量所以,CO的体积分数大于x
C 、CO+H2O(g)  CO2+H2
CO2+H2
n起? 0.5? 1.5? 0.4? 0.4
n变? 0.4? 0.4? 0.4? 0.4
n终? 0.9? 1.9? 0? 0
所以相当于加入了0.9mol CO,和加入1.9molH2O ,?相当增大了H2O的浓度所以平衡正向移动,所以CO的转化率增大了,CO的体积分数小于x
D 、CO+H2O(g)  CO2+H2
CO2+H2
n起? 0.5? 1.5? 0.5? 0.5
n变? 0.5? 0.5? 0.5? 0.5
n终? 1? 2? 0? 0
所以相当于加入了1mol CO,和加入2molH2O? ,所以CO的体积分数为x
点评:本题考查学生对化学平衡中等效平衡的理解以及对可逆反应的影响因素的熟悉掌握。
本题难度:简单