| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《化学平衡状态的判断》高频试题预测(2017年最新版)(五)
 (5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。 (5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。   ①请在上表格中填入剩余的实验条件数据。 ①请在上表格中填入剩余的实验条件数据。 ②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。 ②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。 2、填空题 (8分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(3)一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率, 可以采取的措施是?。 A.降低温度?B.加催化剂? C.增加压强?D.增加O2浓度 E.分离出一氧化氮 (4)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应: N2(g)+O2(g)  2NO(g)达到平衡时NO的浓度?。(此温度下不考虑O2与NO的反应,计算结果保留两位有效数字) 2NO(g)达到平衡时NO的浓度?。(此温度下不考虑O2与NO的反应,计算结果保留两位有效数字)(5) NO在科学界被誉为“明星分子”, 用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂。已知 火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气)。 且:N2(g)+2O2(g)=2NO2(g) ? △H=+67.7kJ/mol N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol 请写出肼与NO2反应的热化学方程式_______________________________________________ 3、填空题 氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:3SiO2(s) + 6C(s) + 2N2(g) 4、填空题 在温度为298K时,将0.10 mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g) (3)在温度为298K时,达到平衡时四氧化二氮的转化率α1等于?。化学平衡常数为?。 (4)若在7s时向该密闭容器中再充入0.10 mol N2O4气体,此时平衡向?方向移动(填“正”或“逆”);再次达平衡时,总计0.20 mol N2O4的转化率为α2,正确的是? (? ) A.α2<α1? B.α2>α1? C.α2=α1? D.无法判断。 (5)下表是不同温度下测定的该反应的化学平衡常数。
据此判断该反应正反应是?反应(填“吸热”或“放热”) (6)若其他条件不变,反应在398K条件下进行并达到平衡,此温度下N2O4的浓度随时间变化的曲线(以298K条件下进行并达到平衡的曲线作为参照)正确的是? (? ) 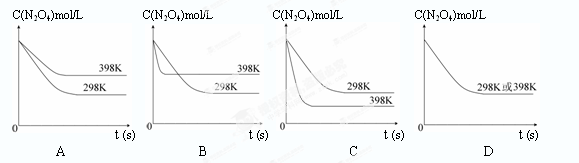 5、实验题 用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=_______mol·L-1。(假设混合溶液体积为50 mL) (3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定?来比较化学反应速率。 (4)小组同学发现反应速率总是如下图,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂、②?。 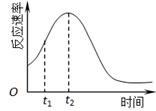 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《元素周期律.. | |