微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是?(?)
A.NH4+和H3O+两个离子的电子数、质子数、中子数相等
B.1H2和2H2互为同位素,它们的质子数相等
C.14C和14N的质量数相等,它们是同素异形体
D.14C16O和12C18O两个分子所含质子数、中子数和原子个数均相等
参考答案:D
本题解析:略
本题难度:一般
2、填空题 (1)19世纪末,人们开始揭示原子内部的秘密,最早发现电子的科学家是________。
(2)道尔顿的原子学说曾起了很大的作用。他的学说包含下列三个论点:①原子是不能再分的粒子,②同种元素的原子的各种性质和质量都相同,③原子是微小的实心球体。从现代的观点看,你认为三个论点中不确切的是________。
参考答案:(1)汤姆逊 (2)①②③
本题解析:(1)最早发现电子的科学家是汤姆逊;(2)从现代化学理论看:①原子是能再分的粒子,②同种元素的原子的各种性质和质量不一定相同,③原子不是微小的实心球体。所以上述三个论点均不确切。
本题难度:简单
3、选择题 四种主族元素的离子a Xm+,bYn+,cZn-和dRm-(a,b,c,d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
①a-b=n-m?②元素的原子序数a>b>c>d
③元素非金属性Z>R?④最高价氧化物对应水化物碱性X>Y
A.②③正确
B.只有③正确
C.①②③④正确
D.①②③正确
参考答案:A
本题解析:a Xm+中a为质子数。而电子数为a-m.,而 bYn+的电子数为b-n
cZn的电子数为c+n?dRm-的电子数为d+m.由于它们具有相同的电子层结构所以a-m.,=
b-n故①是错误的。而④中,X与Y应属于同一个周期,且m>n所以X的原子序数应该比Y 的要大,所以X的半径比Y的要小,半径越小,碱性越弱,所以碱性应该是Y的强。故④是错误的。所以答案选A
本题难度:一般
4、选择题 .已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子半径:A>B>D>C
B.原子序数:d>c>b>a
C.离子半径:C3->D->B+>A2+
D.单质还原性:A>B>D>C
参考答案:C
本题解析:四元素在周期表中的相对位置如下所示:

微粒半径主要是电子层数及核电荷数决定。
本题难度:简单
5、填空题 (16分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语
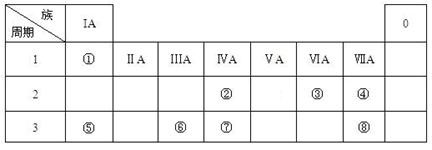
回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为_______________________,②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是______________________。
(2)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl 3 c.Na2SO3 d.KMnO4
若已知1 克该液态化合物分解成③的单质和一种常见液体时,可放出2.9kJ能量,写出该反应的热化学方程式:?
(3)工业上常采用电解A和冰晶石(Na3AlF6)混合物的方法冶炼制备⑥的单质,请从A晶体的类型和微粒间的相互作用力角度解释加冰晶石(Na3AlF6)的原因?。?并写出电解时的电极反应式:?。
(4)甲、乙、丙是上述部分元素组成的双原子分子或负二价双原子阴离子,且甲、乙、丙的电子总数相等。甲是一种极强的氧化性单质。丙与⑤的阳离子可形成一种淡黄色固体B,该固体跟水反应可得到③的单质。则B电子式?,乙的结构式?,甲的组成元素的原子结构示意图?,能证明甲的组成元素非金属性很强的事实?。(任举一例即可)
参考答案:(1)Na>Al> F ? HClO4>H2CO3>H2SiO3?
(2) a? b? 2H2O2(l)=2H2O(l)+O2(g) ?ΔH=-197.2kJ·mol-1
(3)氧化铝为离子晶体,破坏离子键需要较多的能量,加冰晶石能降低熔点
阳极:2O2——4e-=O2?阴极 Al3++3e—=Al
(4)?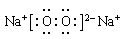 ?H—Cl?
?H—Cl?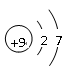 ?与H2在暗处就能化合或HF很稳定
?与H2在暗处就能化合或HF很稳定
本题解析:考查周期表的结构和元素周期律的应用。根据元素在周期表中的相对位置可以得出,①是氢元素,②碳元素,③氧元素,④氟元素,⑤钠元素,⑥铝元素,⑦硅元素,⑧氯元素,⑨硫元素。
本题难度:一般