微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 按下列要求写出由第二周期非金属元素组成的中性分子的相关内容:
(1)平面三角形分子:分子式_____________,中心原子杂化方式是___________________。
(2)三角锥形分子:分子式______________,VSEPR模型为?。
(3)正四面体形分子:结构式______________,中心原子杂化方式是__________________。
(4)互为等电子体的两对物质的分子式:N2和_____________,CO2和_________________。
参考答案:(1)BF3? SP2?(2)NF3?四面体形
(3)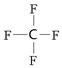 ? SP3?(4)CO? N2O
? SP3?(4)CO? N2O
本题解析:在第二周期元素形成的分子中,属于平面三角形的是BF3,中心原子没有孤对电子,所以是sp2杂化;属于三角锥形的是氨气,中心原子氮原子含有(5-3×1)÷2=1,所以VSEPR模型为四面体型;属于正四面体型结构的是四氟化碳,结构式是 ,中心原子没有孤对电子,属于sp3杂化;原子数和价电子数分别都相等的是等电子体,所以和 互为等电子体的是CO,和CO2互为等电子体的是N2O。
,中心原子没有孤对电子,属于sp3杂化;原子数和价电子数分别都相等的是等电子体,所以和 互为等电子体的是CO,和CO2互为等电子体的是N2O。
点评:该题是中等难度的试题,也是高考中的常见题型和重要的考点。试题紧扣教材,难易适中,基础性强。旨在培养学生灵活运用基础知识甲基实际问题的能力,有利于培养学生的逻辑推理能力和创新思维能力。
本题难度:一般
2、填空题 开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4—构成,BH4—呈正四面体构型。LiBH4中不存在的作用力有______(填标号)。
A.离子键?B.共价键?C.金属键?D.配位键
③Li、B、H元素的电负性由大到小排列顺序为______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:

M是______(填元素符号)。
(3)某种新型储氢材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有______种。
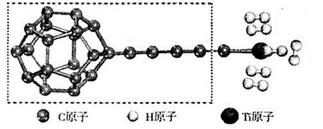
(4)分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是______(填标号)。
A.H2O?B.CH4?C.HF ?D.CO(NH2)2
参考答案:(13分)
(1)①1(1分)
②C(2分)
③H>B>Li(2分)
(2)①<(2分)
②Mg(2分)
(3)3(2分)
(4)B、C(2分)
本题解析:(1)、①钛是22号元素,基态钛原子电子排布式为1s22s22p63s23p63d24s2,Ti—3e—=Ti3+,则基态Ti3+的电子排布式为1s22s22p63s23p64s1,未成对电子数为1;②Li+和BH4—之间存在离子键,BH4—之间存在共价键和配位键,则硼氢化锂中不存在金属键;③LiBH4中LiH同主族,LiB同周期,由元素周期律可知,则锂元素的电负性最小,BH4—中硼显+3价,氢显—1价,说明氢的电负性比硼大,则H>B>Li;(2)、①Li+和H—具有K层2电子稳定结构,核电荷数:Li>H,则原子半径:Li+<H—;②根据M的部分电离能数据推断,M为容易失去2个电子的镁元素;(3)、观察可知,虚线框内碳原子杂化轨道类型有sp2杂化(五元环中的大多数碳原子)、sp3杂化(五元环中与侧链相连的碳原子)、sp(侧链中的碳原子)杂化三种类型;(4)、水分子中O—H键与相邻水分子中电负性较大的O之间可以形成氢键,且形成笼状结构;B、甲烷分子中碳元素的电负性较小,故不能形成氢键,也不能形成笼状结构;C、氟化氢分子中F—H键与相邻氟化氢分子中电负性较大的F之间能形成氢键,但是不能形成立体笼状结构,错误;D、尿素中电负性较大的O、N与相邻分子中的N—H键之间不仅可以形成氢键,而且可以形成笼状结构。
本题难度:一般
3、选择题 同学们使用的涂改液中含有很多有害的挥发性物质,二氯甲烷就是其中一种,吸入会引起慢性中毒,有关二氯甲烷的的说法正确的是(?)
A.键能均相等
B.键角均为109°28′
C.有两种同分异构体
D.该分子共含电子总数为42
参考答案:D
本题解析:碳氢键和碳氯键的键能是不相同的,选项A不正确;二氯甲烷不是正四面体形结构,键角不是109°28′,选项B不正确;二氯甲烷没有同分异构体,选项C不正确,所以正确的答案选D。
本题难度:一般
4、选择题 下列各组有机物中,只需加入溴水就能一一鉴别的是(?)
A.甲苯、苯、已烯
B.已炔、己烯、四氯化碳
C.已烷、苯、乙醇
D.已烯、苯、四氯化碳
参考答案:
D
本题解析:略
本题难度:简单
5、选择题 意大利科学家合成了一种新型的氧分子,其化学式为O4。下列关于O4说法正确的是
A.一个分子O4有两个分子O2构成
B.O4是一种单质
C.等质量的O4和O2含有相同数目的分子
D.O4是一种化合物
参考答案:B
本题解析:
答案:B
A、?不正确,分子中没有分子。B、?正确:O4是同种元素形成的纯净物,一种单质;
C、?不正确,等质量的O4和O2含有相同数目的原子? D、不正确,O4是一种单质
本题难度:简单