微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以下推断或现象错误的是( )
A.离子化合物可能完全由非金属元素组成
B.邻二氯苯没有同分异构体,说明苯分子中不存在单、双键交替相连的结构
C.A、B两种金属用导线相连接浸泡在稀硫酸溶液中,形成原电池,金属A作负极,金属B表面产生气泡,但同样金属A直接与该稀硫酸溶液反应时,溶解腐蚀的速度会更快
D.在3?mL?5%的H2O2溶液中,滴加2滴1mol/L的FeCl3溶液,观察到溶液颜色由黄色变到红褐色,当溶液无气泡产生后,溶液颜色又恢复至黄色,FeCl3在催化过程中可能参加了化学反应
参考答案:C
本题解析:
本题难度:简单
2、简答题 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
请回答下列问题:
(1)Y在元素周期表中的位置为______.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是______(写化学式),非金属气态氢化物还原性最强的是______(写化学式).
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______(写出其中两种物质的化学式).
(4)X2M的燃烧热△H=-a?kJ?mol-1,写出X2M燃烧反应的热化学方程式:______.
(5)ZX的电子式为______;ZX与水反应放出气体的化学方程式为______.
(6)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:2Z+FeG2?
?Fe+2ZG.? 放电时,电池的正极反应式为______;充电时,______(写物质名称)电极接电源的负极;该电池的电解质为______.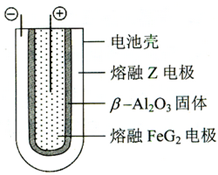
参考答案:X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,X为主族元素,所以X是H元素;X、Z同主族,可形成离子化合物ZX,Y为主族元素,且Z原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素(不考虑稀有气体),
(1)Y是O元素,O原子有2个电子层,最外层电子数为6,处于第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)非金属性越强,其相应的最高价含氧酸的酸性越强,这几种元素非金属性最强的是Cl元素,所以其最高价含氧酸的酸性最强的是高氯酸HClO4,非金属性越弱,气态氢化物还原性越强,还原性最强的气态氢化物是硫化物?H2S,故答案为:HClO4;H2S;
(3)Y的单质O3、G的单质Cl2、二者形成的ClO2可作消毒剂,故答案为:O3、Cl2等;
(4)H2S的燃烧热△H=-a?kJ?mol-1,根据燃烧热的含义,H2S燃烧的热化学方程式生成物应该生成SO2,故H2S燃烧反应的热化学方程式为:2H2S(g)+3O2(g)=2?SO2(g)+2H2O(l)△H=-2aKJ?mol-1,
故答案为:2H2S(g)+3O2(g)=2?SO2(g)+2H2O(l)△H=-2aKJ?mol-1;
(5)ZX为NaH,属于离子化合物,由钠离子与氢负离子构成,电子式为
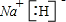
,Na与水反应是氢氧化钠与氢气,反应化学方程式为为:NaH+H2O=NaOH+H2↑,
故答案为:
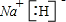
;NaH+H2O=NaOH+H2↑;
(6)熔融状态下,Na的单质和FeCl2能组成可充电电池,反应原理为:2Na+FeCl2?充电
本题解析:
本题难度:一般
3、选择题 氯化溴(BrCl)结构和性质类似Br2、Cl2下列叙述正确的是
A? BrCl是离子化合物? B . Br-Cl键长大于Cl-Cl键长
C.? BrCl 和Br2中都存在极性键? D.? BrCl和Cl2都是非极性分子
参考答案:B
本题解析:
正确:B
A、不正确,BrCl是共价化合物? B .正确,Br?原子半径大,Br-Cl键长大于Cl-Cl键长; C. 不正确,Br2中不存在极性键? D. 不正确,BrCl是极性分子。
本题难度:一般
4、选择题 下列粒子的结构表示正确的是
[? ]
A.18O的结构示意图
B.O2-的结构示意图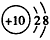
C.Ca2+的电子式
D.Mg2+的电子式:Mg2+
参考答案:D
本题解析:
本题难度:简单
5、简答题 已知元素电负性的差值大于1.7时,原子间形成离子键,小于1.7时,原子间形成共价键,请指出下列原子之间形成的化学键是离子键还是共价键.
Be(1.5)和F(4.0):______,Si(1.8)和Cl(3.0):______.
参考答案:元素电负性的差值大于1.7时,原子间形成离子键,小于1.7时,原子间形成共价键,氟元素和铍元素的电负性的差=4.0-1.5=2.5>1.7,所以氟元素和铍元素易形成离子键,氯元素和硅元素的电负性的差=3.0-1.8=1.2<1.7,所以氯元素和硅元素易形成共价键,
故答案为:离子键;共价键.
本题解析:
本题难度:简单