微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质的溶液加热蒸发至干、灼烧,所得固体的成分不相同的是(?)
A.FeCl2、Fe2(SO4)3
B.FeCl2、FeCl3
C.NaHCO3、Na2CO3
D.Mg(HCO3)2、MgCl2
参考答案:A
本题解析:略
本题难度:一般
2、选择题 25 ℃时,某NH4Cl溶液的pH为4,下列说法中不正确的是(? )
A.溶液中c(H+)>c(OH-)且c(H+)·c(OH-)=1×10-14
B.由水电离出来的c(H+)约为1×10-14 mol·L-1
C.溶液中c(Cl-)>c(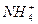 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.此溶液中水的电离度比纯水的电离度大
参考答案:B
本题解析:本题主要考查发生水解反应的盐溶液中水的电离平衡的移动及溶液中离子浓度大小的比较。在NH4Cl溶液中因: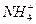 +H2O
+H2O NH3·H2O+H+而显酸性,常温下,稀溶液的KW保持不变,A正确;该溶液中c(H+)=1×10-4 mol·L-1,全部由水电离得到,故B不正确;NH4Cl溶液中
NH3·H2O+H+而显酸性,常温下,稀溶液的KW保持不变,A正确;该溶液中c(H+)=1×10-4 mol·L-1,全部由水电离得到,故B不正确;NH4Cl溶液中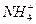 水解,c(H+)>c(OH-),但
水解,c(H+)>c(OH-),但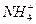 水解程度不大,往水中加入能水解的盐,将使水的电离平衡向正反应方向移动,使水的电离程度增大,C、D正确。
水解程度不大,往水中加入能水解的盐,将使水的电离平衡向正反应方向移动,使水的电离程度增大,C、D正确。
本题难度:简单
3、选择题 某溶液中存在的离子有:S2-、HS-、OH-、Na+、H+,则下列有关对该溶液的叙述中不正确的是( )
A.离子浓度可能是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
B.组成该溶液的溶质只能是Na2S或NaHS或两者的混合物
C.该溶液可能呈中性,或碱性,或酸性
D.离子物质的量的关系是2n(S2-)+n(HS-)+n(OH-)=n(Na+)+n(H+)
参考答案:B
本题解析:略
本题难度:简单
4、选择题 下列微粒的浓度关系一定正确的是
A.醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c (Na+)>c(H+)>c(OH一)
B.常温下,物质的量浓度相等的①(NH4)2SO4、②(NH4)2Fe (SO4)2、③NH4HSO4、④NH4C1溶液中c(NH4+)的大小顺序为:②>①>③>④
C.pH=3的盐酸与pH=ll的氨水等体积混合液中:c(H+)=c(OH一)
D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH一)+c(HA一)+c(A2-)
参考答案:B
本题解析:A、当溶液中醋酸钠的浓度远远大于醋酸的浓度时,溶液中c(Na+)>c(CH3COO-),故A错误;
B、等温、等物质的量浓度的铵盐溶液中,①②中铵根离子浓度大于③④。②中亚铁离子抑制铵根离子水解,所以②中铵根离子浓度大于③。③中氢离子抑制铵根离子水解,所以③中铵根离子浓度大于④,所以这四种溶液中铵根离子浓度大小顺序:②>①>③>④,故B正确;
C、pH=3的盐酸与pH=ll的氨水,氨水的物质的量浓度大于盐酸,所以等体积混合,氨水过量,溶液呈碱性,故C错误;
D.根据电荷守恒得c(H+)+ c(Na+)=c(OH一)+ c(HA一)+2c(A2-),故D错误,答案选B。
本题难度:一般
5、选择题 MOH强碱溶液和等体积、等浓度的HA弱酸混合后,溶液中有关离子浓度的比较正确的是
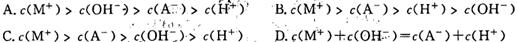
参考答案:C
本题解析:本题考查酸碱混合溶液中离子浓度的关系,明确混合后溶液中的溶质及盐类水解是解答的关键;MOH强碱溶液和等体积、等浓度的HA弱酸溶液混合后,恰好反应为MA,为强碱弱酸盐,水解显碱性,A-水解,则c(M+)>c(A-),水解显碱性,则c(OH-)>c(H+),盐类的水解是微弱的,则c(A-)>c(OH-),则浓度关系为(M+)>c(A-)>c(OH-)>c(H+),选C。
本题难度:简单