| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《原电池原理》高频考点特训(2017年练习版)(四)
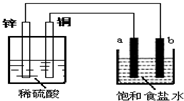 参考答案:左边装置能自发的进行氧化还原反应,符合原电池的构成条件,所以属于原电池,较活泼的 金属锌作负极,铜作正极;右边装置有外接电源,属于电解池,连接锌极是阴极,连接铜极的是阳极. 本题解析: 本题难度:一般 3、选择题 两种金属A与B和稀硫酸组成原电池时,A是正极。下列有关推断正确的是 参考答案:C 本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。两种金属A与B和稀硫酸组成原电池时,A是正极,这说明金属性是B强于A,A不正确;电子不断由B电极经外电路流向A电极,B不正确;正极导电电子,发生还原反应,选项C正确;A的金属活动性不一定排在氢前面,选项D不正确,答案选C。 本题难度:简单 4、选择题 下列叙述正确的是( ) 参考答案:A.电镀时,镀层作阳极,镀件作阴极,所以通常把待镀的金属制品作阴极,故A正确; 本题解析: 本题难度:一般 5、填空题 (9分)下图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: 参考答案:(9分)(1)?铁?,? 4 OH- - 4 e-? = O2 ↑ + 2H2O , 本题解析:(1)甲是燃料电池,通入甲烷的电极是负极,通入氧气的是正极。所以M是阴极,N是阳极。由于工作时M、N两个电极的质量都不减少,所以M是铁,N是石墨,溶液中OH-放电,所以其电极反应式是4 OH- - 4 e- = O2 ↑ + 2H2O,则乙池中总的反应式是4AgNO3+2H2O 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《有机物燃烧.. | |