微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O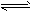 HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
[? ]
A.稀释溶液,水解平衡常数增大
B.通入CO2,平衡朝正反应方向移动
C.升高温度,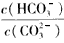 减小
减小
D.加入NaOH固体,溶液pH减小
参考答案:B
本题解析:
本题难度:一般
2、选择题 能够在酸性溶液中水解,生成相对分子质量相同的两种物质的是
A.蔗糖
B.淀粉
C.油脂
D.麦芽糖
参考答案:A
本题解析:略
本题难度:简单
3、选择题 下列说法中,正确的是(?)
A.粗铜精炼时,阳极产生0.5molCu2+则阴极有NA个Cu原子析出
B.因为酸性H2SO3>H2CO3,所以S得电子能力大于C
C.可通过比较Mg(OH)2和MgCO3的Ksp的大小 比较它们的溶解性
D.含0.1molNaClO的溶液蒸干可得5.85gNaCl固体
参考答案:D
本题解析:A、由于粗铜中含有杂质,开始时阳极不是铜失去电子,而阴极始终是铜离子放电。因此粗铜精炼时,阳极产生0.5molCu2+则阴极不一定有NA个Cu原子析出,A不正确;非金属性越强,最高价氧化物的水化物的酸性越强,亚硫酸不是强酸,B不正确;C、氢氧化镁和碳酸镁的组成结构不同,所以不能通过比较Mg(OH)2和MgCO3的Ksp的大小 比较它们的溶解性,C不正确;D、次氯酸钠溶于水,水解生成次氯酸和氢氧化钠,由于次氯酸不稳定,易分解生成氯化氢和氧气,所以最终得到的是氯化钠。根据原子守恒可知,氯化钠的物质的量是0.1mol,D正确,答案选D。
本题难度:一般
4、选择题 常温时,V1mL c1 mol/L的醋酸滴加到V2 mL c2 mol/L的烧碱溶液中,下列结论正确的是
A.若V1=V2且混合溶液pH<7,则有c1>c2
B.若c1V1= c2V2,则混合溶液中c(Na+)= c(CH3COO-)
C.若混合溶液的pH=7,则有c1V1>c2V2
D.若混合溶液的pH=7,则混合溶液中c(Na+)>c(CH3COO-)
参考答案:AC
本题解析:若V1=V2,c1= c2,则c1V1= c2V2,即醋酸与烧碱恰好完全中和,得到醋酸钠和水,醋酸钠是强碱弱酸盐,根据盐类水解规律可知混合溶液pH>7,欲使混合溶液pH<7,则醋酸一定过量,则c1>c2,故A正确;若c1V1= c2V2,即醋酸与烧碱恰好完全中和,混合后得到CH3COONa溶液,CH3COONa是强碱弱酸盐,钠离子不水解,醋酸根离子部分水解,则混和后溶液中c(Na+)>c(CH3COOˉ),故B错误;若醋酸与烧碱恰好完全中和,混合溶液pH>7,欲使混合溶液pH=7,则醋酸必须适当过量,则c1V1>c2V2,故C正确;混合溶液中含有的离子是CH3COOˉ、Na+、H+、OHˉ,由电荷守恒原理可得:c(H+)+c(Na+)=c(CH3COOˉ)+ c(OHˉ),混合溶液pH=7,则c(H+)=c(OHˉ),因此c(Na+)=c(CH3COOˉ),故D错误。
本题难度:简单
5、选择题 有关0.1 mol/L的NH4Cl溶液的下列说法错误的是
A.[H+]+[NH4+]=[Cl-]+[OH-]
B.[Cl-]>[NH4+]>[H+]>[OH-]
C.[H+]=[OH-]+[NH3﹒H2O]
D.加水稀释,NH4+的水解程度增大,酸性增强
参考答案:D
本题解析:考查了盐类的水解及微粒浓度的大小比较。NH4Cl溶液中存在电荷守恒:[H+]+[NH4+]=[Cl-]+[OH-],物料守恒:[NH3﹒H2O]+[NH4+]=[Cl-],将后式代入前式可得:[H+]=[OH-]+[NH3﹒H2O]
而稀释过程中,虽然促进盐的水解,但总体来讲溶液的酸性减弱,故答案为D
本题难度:一般