微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 通过对下图的观察,有以下几种叙述,其中不正确的是(? )
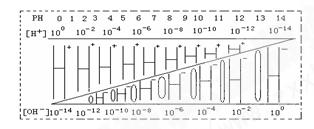

A.该温度下,不论何种水溶液中c(H+)·c(OH-)乘积相等,即水的离子积是一个常数
B.若醋酸钠溶液中c(Na+)=c(CH3COO-),则溶液中的c(H+)=c(OH-)
C.如果定义pOH=-lg[c(OH-)]时,则该温度下某水溶液中的pOH和pH之和等于14
D.某水溶液由于条件的改变,如果氢离子浓度变小,则氢氧根离子浓度一定变大
参考答案:D
本题解析::由图中知道c(H+)·c(OH-) 乘积始终是10-14,A、B正确,醋酸钠溶液中电中性则c(Na+)+ c(H+)=c(OH-)+c(CH3COO-),若c(Na+)=c(CH3COO-),则溶液中的c(H+)=c(OH-),B正确; 改变条件下的时候氢离子浓度变小有可能是温度减小,则氢氧根离子浓度变小,在温度不变的时候,才是一定增大。
改变条件下的时候氢离子浓度变小有可能是温度减小,则氢氧根离子浓度变小,在温度不变的时候,才是一定增大。
本题难度:简单
2、选择题 实验测得常温下0.1 mol/L某一元酸(HA)溶液的pH不等于1,0.1 mol/L某一元碱(BOH)溶液里: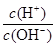 =10-12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是(? )
=10-12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是(? )
A.c(B+)>c(A-)>c(OH-)>c(H+)
B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(H+)>c(A-)>c(OH-)>c(B+)
D.c(B+)>c(A-)>c(H+)>c(OH-)
参考答案:A
本题解析:常温下,0.1 mol/L某一元酸(HA)溶液的pH不等于1,说明HA没有完全电离,是弱电解质;0.1 mol/L某一元碱(BOH)溶液里: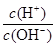 =10-12,则c(OH-)=0.1 mol/L,说明BOH能完全电离,是强电解质。将这两种溶液等体积混合后,HA和BOH恰好完全反应生成强碱弱酸盐BA,A-水解导致溶液显碱性,A项正确。
=10-12,则c(OH-)=0.1 mol/L,说明BOH能完全电离,是强电解质。将这两种溶液等体积混合后,HA和BOH恰好完全反应生成强碱弱酸盐BA,A-水解导致溶液显碱性,A项正确。
本题难度:一般
3、选择题 常温下,向等物质的量浓度的两种一元酸的盐溶液中,分别通入少量的CO2,发生如下反应:NaA+CO2+H2O===HA+NaHCO3 2NaB+CO2+H2O===2HB+Na2CO3,则等物质的量浓度的HA和HB在水中电离出H+的能力大小关系是? ( )
A.HA较强
B.HB较强
C.两者一样
D.无法比较
参考答案:A
本题解析:比较两钠盐与碳酸反应产物可知,NaA生成NaHCO3,而NaB得到的是Na2CO3,说明酸根离子B—相对A—更易结合H+,进而可知,HB相对电离出H+的能力差,其酸性相对较弱,HA酸性较强,故选A
本题难度:一般
4、选择题 某实验小组进行了如图所示的实验。下列说法不正确的是
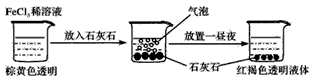
[? ]
A.红褐色液体为氢氧化铁胶体
B.加入石灰石是为了促进氯化铁水解
C.产生的气泡是HCl气体
D.产生的气泡是CO2气体
参考答案:C
本题解析:
本题难度:一般
5、选择题 在一定条件下,Na2CO3溶液存在水解平衡:CO32- + H2O HCO3-+OH-。下列说法错误的是
HCO3-+OH-。下列说法错误的是
A.稀释溶液,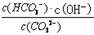 增大
增大
B.通入CO2,溶液PH减小
C.升高温度,水解平衡常数增大
D.加入NaOH固体,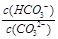 减小
减小
参考答案:A
本题解析:
答案:A
A、不正确,该反应的平衡常数K=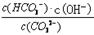 ,只随温度改变而改变,所以稀释溶液,
,只随温度改变而改变,所以稀释溶液,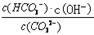 不变。B、正确,通入CO2,平衡正向移动,溶液PH减小;C、正确,升高温度,水解吸热,平衡正向移动,水解平衡常数增大;D、正确,加入NaOH固体,平衡逆向移动,
不变。B、正确,通入CO2,平衡正向移动,溶液PH减小;C、正确,升高温度,水解吸热,平衡正向移动,水解平衡常数增大;D、正确,加入NaOH固体,平衡逆向移动,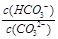 减小。
减小。
本题难度:一般