微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
A.
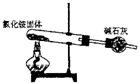
B.

C.
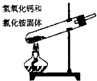
D.
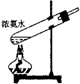
参考答案:AC
本题解析:
本题难度:一般
2、简答题 实验室常用加热铵盐和碱的固体混合物的方法制取氨气.根据如图回答问题:
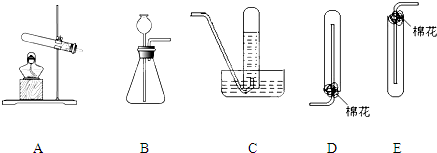
(1)实验室制取氨气的发生装置为______(填序号),该反应的化学方程式为______.
(2)下列气体可以用与氨气相同的收集装置收集的是______(填序号).
A.H2 B.CO2?
参考答案:(1)由于实验室制取氨气需要加热,应该是A装置;反应的化学方程式是:2NH4Cl+Ca(OH)2 △.CaCl2+2NH3↑+2H2O,
故答案是:A;2NH4Cl+Ca(OH)2 △.CaCl2+2NH3↑+2H2O;
(2)由于氨气极易溶于水,密度小于空气的,所以收集方法采用的是向下排空气法,
A、氢气密度比空气下,采用向下排空气法,故A正确;
B、二氧化碳密度比空气大,不能使用向下排空气法,故B错误;
故选A.
本题解析:
本题难度:一般
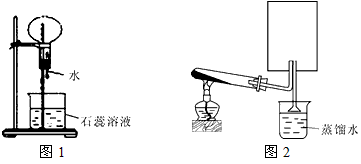
3、填空题 A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B。用圆底烧瓶收集干燥的B,按图1装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;实验室也可用A与浓H2SO4反应制无色气体C,C气体能使品红溶液褪色。用圆底烧瓶收集干燥的C,仍按图1装置仪器,挤压滴管的胶头时,可以得到红色喷泉。
(1)A晶体的化学式是_____________,B气体的化学式_____________
(2)图2是制取并收集气体B的部分装置,在图中方框内绘出用圆底烧瓶收集B的仪器装置简图,图中倒置漏斗的作用______________________
(3)若用一支试管来收集B,检验B气体是否收集满的方法及现象是______________________
参考答案:(1)(NH4)2SO3或NH4HSO3;NH3
(2) ;防倒吸
;防倒吸
(3)将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则说明已收集满(答案合理即可)
本题解析:
本题难度:一般
4、选择题 下列气体可用启普发生器制取的是
[? ]
(1)H2S (2)SO2 (3)HCl (4)Cl2
A、只有(1)
B、(1)和(4)
C、(1)(2)(4)
D、(1)和(2)
参考答案:A
本题解析:
本题难度:简单
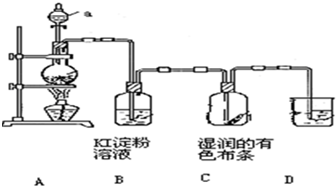
5、简答题 某化学研究性学习小组设计制取氯气及探究其性质的方案,并按下图所示装置完成实验.(A中发生反应的化学方程式为:MnO2+4HCl(浓)═MnCl2+
Cl2↑+2H2O).
(1)装置A中,仪器a的名称是______.
(2)装置B中无色溶液将变为______色,该反应的化学方程式是______.
(3)装置C中湿润的有色布条______(填“褪色”或“不褪色”),其原因是氯气与水反应生成了______(填化学式).
(4)为了吸收多余的氯气,防止造成空气污染,装置D中应盛放______溶液.
(5)用8.7g MnO2与足量浓盐酸反应,被氧化的盐酸的物质的量为______.
(6)某同学查阅资料得知:高锰酸钾与浓盐酸在常温正好生反应也可以生成氯气(反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O),该反应的氧化剂是______.
(7)如反应中转移了0.50mol电子,则产生的气体在标准状况下体积为______L.
(8)若氯气泄漏,某同学用湿毛巾捂住鼻子防止中毒,有以下四种溶液可浸湿毛巾,它们分别是:①NaOH溶液②NaCl溶液③KBr溶液④NaHCO3溶液,正确选择是______(填序号).
参考答案:(1)实验室制备氯气用浓盐酸和二氧化锰在加热条件反应,所用反应仪器为分液漏斗和圆底烧瓶,通过分液漏斗向烧瓶中加人适量的浓盐酸,
故答案为:分液漏斗;
(2)氯气具有氧化性,能将碘离子氧化成碘单质,所以氯气与碘化钾溶液反应Cl2+2KI═2KCl+I2生成I2,I2遇淀粉变蓝,棉球变蓝,
故答案为:蓝;Cl2+2KI═2KCl+I2;
(3)湿润的红色布条中的水和氯气反应生成盐酸和次氯酸,生成的HClO具有漂白性,将湿润的红色布条漂白褪色,
故答案为:褪色;HClO;
(4)氯气是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收过量的氯气,氯气与NaOH反应生成氯化钠和次氯酸钠,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:NaOH;
(5)8.7g的MnO2的物质的量=8.7g87g/mol=0.1mol,则:
MnO2+4HCl(浓)△.MnCl2+Cl2↑+2H2O
0.1mol 0.1mol
被氧化的HCl生成生成氯气,根据氯原子守恒可知n被氧化(HCl)=2n(Cl2)=0.1mol×2=0.2mol,
故答案为:0.2mol;
(6)在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O的反应中,Mn元素化合价降低,所以KMnO4 是氧化剂,
故答案为:KMnO4;
(7)在4HCl(浓)+MnO2△.Cl2↑+MnCl2+2H2O中,Mn元素的化合价降低,Cl元素得化合价升高,则MnO2为氧化剂,HCl为还原剂,由方程式可知,盐酸在反应中起到酸性和还原剂的作用,4molHCl参加反应,生成1molCl2,Cl元素化合价由-1价升高到0价,由Cl2~2Cl- 可知,被氧化的Cl-的物质的量1mol×2=2mol,转移电子数为2NA,当反应中转移了0.50mol电子,则产生的气体0.25mol,标况下其体积为0.25mol×22.4L/mol=5.6L,
故答案为:5.6;
(8)用湿毛巾捂住鼻子防止中毒,应选弱碱性物质吸收氯气,只有④符合,而①碱性太强,②抑制氯气溶解,③反应生成有毒物质溴,
故答案为:④.
本题解析:
本题难度:一般