微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
⑴SO2和O2反应制取SO3的反应原理为:2SO2+O2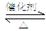 2SO3,在一密闭容器中一定时间内达到平衡.
2SO3,在一密闭容器中一定时间内达到平衡.
①该反应的平衡常数表达式为: .
②该反应达到平衡状态的标志是 .
A.v(SO2)=v(SO3) B.混合物的平均相对分子质量不变
C.混合气体质量不变 D.各组分的体积分数不变
⑵某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.

①B电极的电极反应式为 ;
②溶液中H+的移动方向由 极到 极;(用A、B表示)
⑶测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL溶液
b.量取25 mL待测液于锥形瓶中
c.用硫酸酸化的0.01 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40 mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式).
Fe2++ 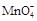 + —— Fe3++ Mn2++
+ —— Fe3++ Mn2++
②用硫酸酸化的KMnO4滴定终点的标志是 .
③计算上述产品中FeSO4·7H2O的质量分数为 .
参考答案:⑴① ②BD
②BD
⑵①SO2+2H2O-2e-==SO42-+4H+ ②B A
⑶①5Fe2++1 +8H+===5Fe3++1Mn2++4H2O
+8H+===5Fe3++1Mn2++4H2O
②滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色。 ③0.975或97.5%
本题解析:(1)①根据平衡常数的概念可知 。
。
②A项没有正逆反应速率,不能判断;B项混合物的平均相对分子质量反应前后不同,可以判断;C项混合气体的质量反应前后不变,不能判断;D项各组分的体积分数反应前后不同,可以判断。答案选BD。
(2)①根据B极的产物可以看出B极发生氧化反应,是负极,电极方程式为SO2+2H2O-2e-=SO42-+4H+。
②阳离子向正极移动,所以H+从B极向A极移动。
(3)①根据化合价升降法,方程式配平为5Fe2++1 +8H+===5Fe3++1Mn2++4H2O。
+8H+===5Fe3++1Mn2++4H2O。
②KMnO4本身有颜色,所以不需要指示剂,用本身的颜色就可以判断终点,当滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色时达到滴定终点。
③产品中FeSO4·7H2O的质量分数为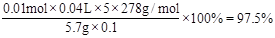 。
。
考点:化学平衡、原电池和氧化还原滴定
点评:本题综合性强,难度较大,非常锻炼学生的思维能力。
本题难度:困难
2、选择题 在化学分析中草酸(H2C2O4)是重要的还原剂,已知20.00 mL 0.100 mol·L-1 VO2+离子恰好将20.00 mL? 0.050 mol·L-1 H2C2O4完全氧化成CO2,VO2+被还原为VOn+离子,则VOn+中的n值为
A.1
B.2
C.3
D.4
参考答案:B
本题解析:VO2+与H2C2O4的物质的量比为2:1,即:2VO2+ + 1H2C2O4→2VOn+ + 2CO2,反应中有2个电子的转移,V由+5价降至+4价,得n=2
本题难度:一般
3、选择题 2008年北京奥运会主体育场——“鸟巢”,被《泰晤士报》评为全球 “最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是

A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2
C.用金属铝与V2O5冶炼钒,铝作还原剂
D.ETFE膜( )是由两种单体缩聚而成的
)是由两种单体缩聚而成的
参考答案:C
本题解析:合金的熔点通常比组分金属低,硬度比组分金属大,A错误;氮化镓化学式为GaN;由ETFE膜的结构可以看出它是由两种单体加聚而成。
本题难度:一般
4、选择题 在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O,从而可 知在RO3n-中,元素R的化合价是?
[?]
A.+4价
B.+5价
C.+6价
D.+7价
参考答案:B
本题解析:
本题难度:简单
5、选择题 已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
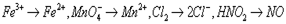 ,
,
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是(? )
A.Fe3+
B.MnO4-
C.Cl2
D.HNO2
参考答案:B
本题解析: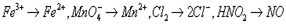 ,四种物质转移的电子数分别为1、5、2、1,所以用等物质的量的这些物质氧化足量的KI,得到I2最多的是MnO4-,所以本题的答案为B。
,四种物质转移的电子数分别为1、5、2、1,所以用等物质的量的这些物质氧化足量的KI,得到I2最多的是MnO4-,所以本题的答案为B。
点评:本题考查了氧化还原反应的有关计算,氧化还原反应是高考考查的重点和难点,本题难度适中。
本题难度:一般