微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示的装置进行有关实验。请回答:
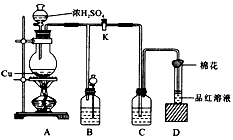
(1)装置A中发生的化学方程式为______________________。
(2)装置D中试管来源:91考试网 91ExAm.org口放置的棉花中应浸入一种液体,这种液体是____,其作用是____。
(3)装置B的作用是储存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A 处仍有气体产生,此时B中现象是_______________。 B中应放置的液体是_____。(填字母)。
a.水
b.酸性KMnO4溶液?
c.浓溴水
d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片与一定体积18 mol/L的浓硫酸放在圆底烧瓶中共热,直到反应完毕。发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是__________________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是____________(填字母)
a.铁粉
b.BaCl2溶液
c.银粉
d.Na2CO3溶液
参考答案:(1)
(2)NaOH溶液;吸收SO2气体
(3)广口瓶B中液体被压入到漏斗中;d
(4)①随着反应的进行,浓硫酸变稀,而稀硫酸不与铜发生反应 ②ad
本题解析:
本题难度:一般
2、实验题 (15分)PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
(一)制备
下图是实验室制备PCI3的装置(部分仪器已省略)
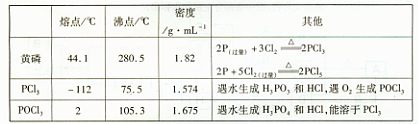
(1)仪器乙的名称?;
(2)实验室制备Cl2的离子方程式:?;
(3)碱石灰的作用是?,?;
(4)向仪器甲中通人干燥Cl2之前,应先通人一段时间的CO2,其目的是?。
(二)提纯
粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过____(填实验操作名称),即可得到PCl3的纯品。
(三)分析
测定产品中PCl3纯度的方法如下:迅速称取m,g产品,水解完全后配成500mL溶液,取出2 5.00mL加入过量的c1mol·L-lV1mL碘溶液,充分反应后再用c2mol·L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液。
5.00mL加入过量的c1mol·L-lV1mL碘溶液,充分反应后再用c2mol·L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
根据上述数据,该产品中PCl3的质量分数为?(用含字母的代数式表示、不必化简)
参考答案:
本题解析:(一)(1)冷凝管,起冷却回流作用;(2)可用MnO2氧化浓盐酸制Cl2;(3)碱石
灰的作用一方面吸收Cl2,防止污染空气,一方面防止空气中的水进入而使PCl3水解;(4)
因PCl3可被氧气氧化,与水反应,所以整个装置要除氧、除水;(二)根据表中的信息,可
通过蒸馏的方法除去PCl3中的杂质;
(三)根据关系式PCl3~H3PO3~I2可求m(PCl3)=137.5x(c1V1-1/2c2V2)x500/25x10-3。
本题难度:一般
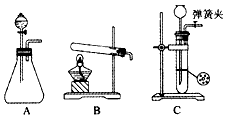
3、实验题 某兴趣小组的学生根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧。为了确定其生成产物并进行实验论证,请你参与以下探究过程。
(1)甲同学首先设计了实验室制取二氧化碳的三种发生装置,若选用碳酸氢钠分解制二氧化碳应选用装置是____(填装置序号“A”“B”或“C”,下同);若用石灰石与稀盐酸为原料,并能控制反应随时发生随时停止,最好应选用的装置是____。
(2)乙同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题
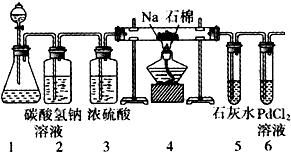
①若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质),加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为_______________。
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为_____________________。
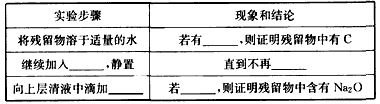
(3)指导老师认为,不仅要检验残留固体中是否有碳酸钠,还要检验其中是否有C和Na2O。当确认钠充分反应后,请你设计一个简单实验来加以验证。可选用的药品有:蒸馏水、盐酸、NaOH溶液、BaCl2溶液、酚酞、品红。
参考答案:(1)B;C
(2)①2Na+2CO2 CO+Na2CO3;②4Na+3CO2
CO+Na2CO3;②4Na+3CO2 2Na2CO3+C (3)
2Na2CO3+C (3)
本题解析:
本题难度:一般
4、简答题 某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质.
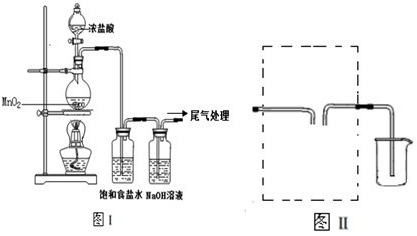
实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯.
(1)烧瓶中反应的化学方程式是______.
(2)饱和食盐水的作用是______.
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图.
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低.
查阅资料:在溶液中发生反应:
(a)Cl2(g)+2NaOH(aq)═NaCl(aq)+NaClO(aq)+H2O(l)?H1=-101.1kJ/mol
(b)3NaClO(aq)═2NaCl(aq)+NaClO3(aq)?H2=-112.2kJ/mol
反应(a)的反应速率很快,反应(b)在室温下较慢,根据资料,请对图Ⅰ装置提出改进建议:______.
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液.他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液.
提出猜想:ⅰ.NaClO把Na2SO3氧化了
ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是______.
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是______.
参考答案:(1)烧瓶中的反应是浓盐酸和二氧化锰价额反应生成氯气、氯化锰和水,反应的化学方程式为:MnO2+4HCl(浓) △.MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)△.MnCl2+Cl2↑+2H2O;
(2)生成的氯气中含有水蒸气和氯化氢气体杂质,饱和食盐水可以吸收氯化氢,减小氯气溶解度;
故答案为:除去氯气中的氯化氢;
(3)收集氯气需要利用排饱和氯化钠溶液的方法收集,导气管短进长出;装置图为:
故答案为: ;
;
(4)反应(a)的反应速率很快,反应(b)在室温下较慢,反应是放热反应,所以可以降低温度促进反应a进行,将盛NaOH溶液的洗气瓶浸在冰水中;
故答案为:将盛NaOH溶液的洗气瓶浸在冰水中;
(5)①实验方案中可以证明NaClO氧化了Na2SO3的实验设计可以利用氧化产物生成硫酸钠判断;
a.向混合后的溶液中加入过量盐酸,无现象说明,故a不符合;
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液,生成白色沉淀证明生成硫酸钡沉淀,证明亚硫酸钠被氧化为硫酸钠,故b符合;
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液,硝酸具有氧化性可以氧化亚硫酸钠为硫酸钠也可以生成硫酸银沉淀干扰氯离子的检验,故c不符合;
d.向混合后的溶液中加入氢氧化钡溶液,生成白色沉淀,再加入过量盐酸沉淀不溶证明原溶液中生成了硫酸钠,证明亚硫酸钠被氧化,故d符合;
故答案为:bd;
②酚酞试液遇碱变红,为证明NaClO氧化了酚酞向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化;
故答案为:向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化.
本题解析:
本题难度:一般
5、实验题 已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。回答下列问题
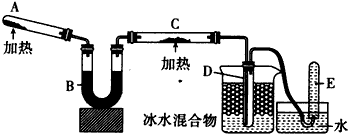
(1)A中加入的物质是_______________。发生反应的化学方程式是_______________。
(2)B中加入的物质是____________,其作用是_______________
(3)实验时在C中观察到的现象是____________,发生反应的化学方程式是___________________。
(4)实验时在D中观察到的现象是___________,D中收集到的物质是____________,检验该物质的方法和
现象是________________。
参考答案:(1)氯化铵和消石灰;2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)碱石灰;干燥氨气
(3)黑色粉末逐渐变成紫红色;2NH3+3CuO N2+3Cu+3H2O
N2+3Cu+3H2O
(4)试管内出现无色液体;氨水;用红色石蕊试纸检验,试纸呈蓝色,用无水硫酸铜粉未检验,粉末变蓝色
本题解析:
本题难度:一般