微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组指定原子序数的元素,不能形成AB2型化合物的是( )?
A.6和8
B.16和8
C. 12和9
D. 11和6
参考答案:D
本题解析:A、原子序数为6和8的元素分别为C元素和O元素,可以生成C0、CO2等化合物,故A不选;
B、原子序数为16和8的元素分别为S元素和O元素,可以生成S02、SO3等化合物,故B不选;
C、原子序数为12和9的元素分别为Mg元素和F元素,可以生成MgF2,故C不选;
D、原子序数为11和6的元素分别为Na元素和C元素,不能生成AB2型化合物,故D选;
故选D。
点评:本题考查原子序数与物质的性质,题目难度不大,注意短周期元素形成的单质和化合物的性质。
本题难度:简单
2、选择题 在通常条件下,下列各组物质的性质排列顺序正确的是:?(?)
A.熔点:CO2>KCl>SiO2
B.水溶性:HCl>H2S>SO2
C.沸点:乙烷>戊烷>丁烷
D.热稳定性:HF>H2O>NH3
参考答案:D
本题解析:A错,CO2为分子晶体,KCl为原子晶体,SiO2为原子晶体,其熔点大小关系为CO2<KCl<SiO2;
B错,HCl气体易溶于水,常温常压下1体积的水约能溶解500体积的HCL;H2S能溶于水,常温常压1体积的水约能溶解2.6体积的H2S;SO2易溶于水,常温常压1体积的水约能溶解40体积的SO2;
C错,对于烷烃的同系,随碳原子数的增多,沸点逐渐升高,正确的顺序为戊烷>丁烷 >乙烷;
D正确,同周期从左到右元素的非金属性逐渐增强,气态氢化物的稳定性逐渐增强;
本题难度:一般
3、选择题 若某ⅡB族元素原子序数为x,那么原子序数为x+1的元素位于
A.ⅢA族
B.ⅢB族
C.ⅠB族
D.ⅠA族
参考答案:A
本题解析:在周期表中,第ⅡB族的右侧应该是第ⅢA族。
本题难度:简单
4、填空题 (15分)下表为元素周期表的一部分,请参照元素A-K在表中的位置,
族
周期
| IA
| ?
| 0
|
1
| A
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| ?
|
2
| ?
| ?
| ?
| B
| C
| D
| ?
| ?
|
3
| E
| ?
| F
| G
| ?
| ?
| K
| ?
|
请回答下列问题:
(1)D、E、F的原子半径由大到小的顺序为_________________________。(用元素符号表示)
(2)B、C、D的第一电离能由大到小的顺序为_________________________。(用元素符号表示)
(3 E、F的最高价氧化物的水化物相互反应的离子方程式_____________________
(4)在B所形成的化合物HCHO、CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有____________;(写结构式,两种)
(5)由A、B、C、D、E元素中某几种组成的10电子微粒子中,含配位键的分子或离子有_________、_________;(写化学式)
(6)由F和K两种元素组成的化合物中,其化学键类型为______________。(填“共价键”或“离子键”),该化合物的二聚体的分子式为Al2Cl6,其结构式为下列四种中的一种,你认为正确的结构是______________。
参考答案:(15分)(1)Na>Al>O(2分)?(2)N>O>C(2分)?(3)Al(OH)3+OH-= AlO2-+2H2O
(4)CH4: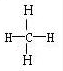 、CH3OH:
、CH3OH: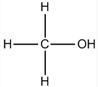 (各1分)
(各1分)
(5)NH4+? H3O+?(各1分)?(6)共价键?③(各2分)
本题解析:(1)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以D、E、F的原子半径由大到小的顺序为Na>Al>O。
(2)非金属性越强,第一电离能越大。但由于氮原子的2p轨道电子处于半充满状态,稳定性强,所以氮原子的大于第一电离能大于氧原子的,即B、C、D的第一电离能由大到小的顺序为N>O>C。
(3)氢氧化铝是两性氢氧化物,能溶于强碱氢氧化钠溶液中,所以 E、F的最高价氧化物的水化物相互反应的离子方程式Al(OH)3+OH-= AlO2-+2H2O。
(4)甲醛是平面型结构,碳原子是sp2杂化,CO是直线型结构,甲烷是正四面体结构,甲醇是四面体结构,碳原子都是sp3杂化,其结构式分别为 、
、 。
。
(5)要形成配位键,必须有提供孤对电子的配体,和接受空轨道的原子或离子。所以含有配位键的是NH4+? H3O+。
(6)氯化铝中含有极性键,属于共价化合物。在该化合物的二聚体中,氯离子是配体,铝原子接受电子,属于答案选③。
本题难度:一般
5、选择题 在下列电子排布式所表示的原子中,第一电离能前者大于后者的是(?)
A.1S22S22P63S23P64S 1与1S22S22P63S1
B.1S22S22P63S2与1S22S22P63S23P1
C.1S22S22P63S23P4与1S22S22P6
D.1S22S22P2与1S22S22P5
参考答案:
B
本题解析:
该题考查原子结构的知识,中等难度题。每项电子排布式所代表的元素是:A.K 和Na; B.Mg 和Al ;C. S 和Ne ;D.C和F。一般来说,同周期元素从左到右的第一电离能越来越大,同主族元素从上到下原子的第一电离能越来越小。稀有气体元素原子的原子轨道为全充满状态,原子结构稳定,整个原子体系的能量较低,第一电离能特别大。Mg 和Al相比,Mg原子具有原子轨道全充满(3S2)的稳定结构,原子体系能量低,Mg 比Al第一电离能大。
本题难度:一般