微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).
(1)E在周期表中的位置?(指明周期和族)。
(2)A、B、C的第一电离能由小到大的顺序为?.
(3)B的氢化物的分子空间构型是?;AC32-的中心原子采取?杂化.
(4)写出任意一种由两种元素组成的与DC2中的阴离子互为等电子体的微粒的化学式?。
(5)E的高价态离子和低价态离子均能与A、B两元素按原子个数比1:1形成的带一个单位负电荷的阴离子组成六配位的配离子。写出该配离子的化学式??(任写一种).
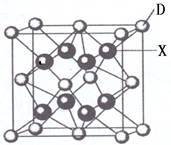
(6)X是周期表中电负性最大的元素,该元素与D元素组成的离子化合物的晶胞如右图所示。该离子化合物的化学式为?.
参考答案:(1)第四周期第Ⅷ族?(2)C<O<N?(3)三角锥形? sp2
(4)IF、BrF、ClF、BrCl、Icl、Ibr、Cl0-等 (5)[Fe(CN)6]3-或者[Fe(CN)6]4-(6)CaF2
本题解析:由题给信息科推知A:C;B:N;C:O;D:Ca;E:Fe.(1)Fe时26号元素,它在元素周期表中的位置是第四周期第Ⅷ族。(2)C的核外电子排布是1s22s22p2;N的核外电子排布是1s22s22p3;O的核外电子排布是1s22s22p4.当原子核外的电子处于全充满或半充满或全空时是稳定的。的第一电离能由小到大的顺序为C<O<N。(3)NH3的分子空间构型是三角锥形。N在锥顶,三个H原子在锥底。CO32-的中心C原子采sp2杂化方式。(4)原子数相同,各原子最外层电子数之和相同的微粒互称为等电子体,它们也具有相似的结构特征。与C22-互为等电子体的微粒有IF、BrF、ClF、BrCl、Icl、Ibr、Cl0-等。(5)E的高价态离子和低价态离子均能与A、B两元素按原子个数比1:1形成的带一个单位负电荷的阴离子组成六配位的配离子是[Fe(CN)6]3-或者[Fe(CN)6]4-。(6)X是周期表中电负性最大的元素,X是F.该元素与D元素组成的离子化合物的晶胞如右图所示。Ca2+:8×1/8+6×1/2=4;F-:8×1=8.Ca2+:F-=4:8=1:2.所以该离子化合物的化学式为CaF2。
本题难度:一般
2、选择题 下列物质不存在共价键的是( )
A.CO2
B.NaOH
C.BaCl2
D.NaNO3
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列物质的电子式书写正确的是
[? ]
A.NaCl:
B.NH4I:
C.HClO: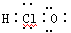
D.H2S:
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列不为同素异形体的是
A.T与D
B.40K与40Ca
C.金刚石与石墨
D.异戊烷与新戊烷
参考答案:ABD
本题解析:略
本题难度:一般
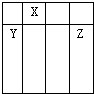
5、选择题 有X、Y、Z三种短周期主族元素,它们在周期表中的位置关系如图,下列有关说法中一定正确的是( )
A.原子半径大小为:Y>Z>X
B.Y与Z形成的化合物是离子化合物
C.若Y为金属元素,则X也为金属元素
D.若Z的最高价氧化物对应的水化物是强酸,则Y元素的最高价氧化物具有两性