| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《电解池原理》在线测试(2017年最新版)(十)
参考答案:C 本题解析:A.根据反应Cu+H2SO4 本题难度:一般 2、选择题 某可充电电池的原理如下图所示,已知a、b为惰性电极,溶液 呈酸性。充电时右槽溶液颜色由绿色变为紫色。下列叙述正确的是 |
参考答案:D
本题解析:A、根据题意知,该装置充电时为电解池,右槽溶液颜色由绿色变为紫色,电极反应为V3++e- = V2+,发生还原反应,b电极为电解池的阴极,与直流电源的负极相连,错误;B、a电极为电解池的阳极,发生氧化反应,电极反应为VO2++H2O—e- VO2++2H+,错误;C、放电时为原电池,a电极为正极,b电极为负极,溶液中阳离子向正极移动,H+从右槽迁移进左槽,错误;D、放电时为原电池,a电极为正极,发生还原反应,电极反应式为VO2++2H++e- = VO2++H2O,左槽溶液颜色由黄色变为蓝色,正确。
VO2++2H+,错误;C、放电时为原电池,a电极为正极,b电极为负极,溶液中阳离子向正极移动,H+从右槽迁移进左槽,错误;D、放电时为原电池,a电极为正极,发生还原反应,电极反应式为VO2++2H++e- = VO2++H2O,左槽溶液颜色由黄色变为蓝色,正确。
考点:考查原电池原理应用,化学电源。
本题难度:一般
3、填空题 Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。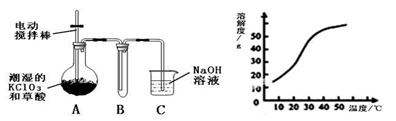
(1)A必须添加温度控制装置,除酒精灯、温度计外,还需要的玻璃仪器有 。
(2)反应后在装置C中可得NaClO2溶液。已知在温度低于38℃时NaClO2饱和溶液中析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据上右图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤: ① 蒸发结晶;② ;③ 洗涤;④ 干燥。
(3)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:① 准确量取ClO2溶液V1mL加入到锥形瓶中,加适量蒸馏水稀释,调节试样的pH≤2.0。② 加入足量的KI晶体,静置片刻。此时发生反应的离子方程式为: ;③ 加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定,至终点时消耗Na2S2O3溶液V2 mL。则原ClO2溶液的浓度为 mol/L(用含字母的代数式表示)。(已知2 Na2S2O3+I2= Na2S4O6+2NaI)
Ⅱ.将由Na+、Ba2+、Cu2+、SO42-、Cl- 组合形成的三种强电解质溶液,分别装入下图装置
中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极。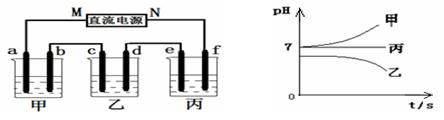
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液pH与电解时间t的关系如右上图(忽略因气体溶解带来的影响)。据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式 ;
(2)电极f上发生的电极反应为 ;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是 。
参考答案:I. (1) 烧杯 (2分) (2) 趁热过滤 (2 分)
(3)2ClO2 + 8H+ + 10I-="==2" Cl—+ 5I2 + 4H2O (3 分) 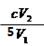 (2 分)
(2 分)
Ⅱ.(1)2CuSO4 + 2H2O  2Cu + O2↑ + 2H2SO4(2分)
2Cu + O2↑ + 2H2SO4(2分)
(2)4OH--4e-=2H2O + O2↑(2分)
(3)向丙烧杯中加入2.25g水(3分)
本题解析:Ⅰ.(1)本题要结合题干所给信息解答。题干中提到制备二氧化氯是由潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得的,因此暗示该反应需要控制反应温度。控制该反应温度在60℃,可以选择60℃的热水浴。因此热水浴的温度控制装置除酒精灯、温度计外,还需要的玻璃仪器应该是能装水浴加热用的大烧杯。
(2)题中已说明NaClO2溶液容易得到2中晶体,而低于38℃时NaClO2饱和溶液中析出晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2 ,因此要得到无结晶水的NaClO2 晶体,要保证在过滤的时候温度高于38℃,因此采用趁热过滤。
(3)酸化的ClO2溶液中加入KI晶体后,溶液变蓝,说明有碘单质生成,所以发生的氧化还原反应离子方程式为2ClO2 + 8H+ + 10I-="==2" Cl—+ 5I2 + 4H2O。
根据已知反应方程式关系得:n(ClO2)="2/5" n(I2) , n(I2)="1/2" n(Na2S2O3),因此n(ClO2)="1/5" n(Na2S2O3)。所以c (ClO2 )= 1/5×c×V2 ÷V1 =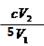 mol/L
mol/L
Ⅱ.从常温下各烧杯中溶液pH与电解时间t的关系图可知,甲、丙两烧杯起始pH值等于7,甲、丙的电解质溶液是强酸强碱盐;乙烧杯起始pH值小于7,电解质溶液为强酸弱碱盐。乙烧杯的电极C质量增重,则可推断增重原因为有金属Cu析出,该电极是阴极,并由此可以得出电源M为负极,N为正极;a、c、e为阴极,b、d、f为阳极。
(1)乙烧杯的电极C质量增重,阴极为Cu2+放电;溶液pH值逐渐降低,说明溶液中阳极OH-放电,使溶液中氢离子增多;所以根据放电情况可以推测得出乙中的电解质溶液为CuSO4溶液,因此电解该溶液的化学方程式为2CuSO4 + 2H2O  2Cu + O2↑ + 2H2S 91ExAM.orgO4 。
2Cu + O2↑ + 2H2S 91ExAM.orgO4 。
(2)丙烧杯中的电解质是强酸强碱盐,随着电解的进行,丙中的溶液pH值不变,则阴极e为H+放电,阳极f上OH-放电,电解实质在电解水,由此可推测该电解质溶液是Na2SO4,因此f电极反应式为4OH--4e-=2H2O + O2↑。
(3)乙烧杯中c电极质量增加了8g,则生成了0.125mol的单质Cu,则转移电子0.25mol,因此丙烧杯中电解消耗0.125mol的水,要使溶液恢复,应该加入0.125mol的水,即2.25g水。
考点:本题考查的是实验仪器和实验操作、电化学基础知识。
本题难度:困难
4、选择题 在如图所示装置中,通电后可观察到Cu极溶解,则下列说法中不正确的是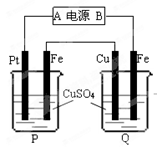
A.直流电源中,A是正极
B.两池内CuSO4溶液浓度均不改变
C.两个铁电极上最初析出物质相同
D.P池内溶液的质量逐渐减小
参考答案:B
本题解析:通电后可观察到Cu极溶解,可知Q池中Cu极是阳极,Fe极是?阴极,则A是正极,B是负极,P池中Pt阳极,Fe极是阴极,两个铁电极上最初析出物质都是铜,P池中CuSO4溶液浓度减小,溶液的质量逐渐减小[;Q池中CuSO4溶液浓度不变,溶液的质量不变。综上所述,B错误,ACD正确。
本题难度:一般
5、填空题 (8分)在用惰性电极电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,下列物质中不能选用的是?(填序号)
A.NaOH
B.H2SO4
C.Na2SO4
D.CuSO4
不能选用上述某物质的原因是(用电极反应式及总反应式表示,若不止一种物质可添加空格填写):
阳极反应式?,
阴极反应式?,
总反应的离子方程式?。
参考答案:(每空2分)D?阳极:4OH–- 4e– =O2+2H2O?阴极:Cu2++ 2e– =Cu
总反应:2Cu2++2H2O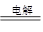 2Cu+O2↑+4H+(漏写条件扣1分,写成化学方程式不得分)
2Cu+O2↑+4H+(漏写条件扣1分,写成化学方程式不得分)
本题解析:考查电极反应式的书写
如果加入硫酸铜,则阴极就是铜离子放电,形成铜,得不到氢气,所以选项D不能用,答案选D;如果加入硫酸铜,则阳极始终是OH-放电,电极反应式是4OH–- 4e– =O2+2H2O。阳极电极反应式是Cu2++ 2e– =Cu,所以总反应式就是2Cu2++2H2O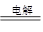 2Cu+O2↑+4H+。
2Cu+O2↑+4H+。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《化学平衡状.. | |