|
高中化学知识点总结《电解池原理》在线测试(2017年最新版)(八)
2017-08-06 10:10:05
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 雾霾已经严重影响我们的生存环境。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。
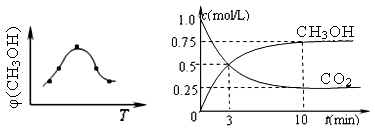 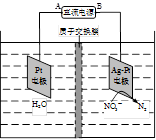
图22-1 图22-2 图22-3
(1)利用甲烷催化还原NOx:
①CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) △H1=-574kJ?mol-1
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)将CO2转化为甲醇的热化学方程式为:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线(见图22-1),则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图22-2所示。
下列说法正确的是 (填字母代号)。
A.第10min后,向该容器中再充入1molCO2和3molH2,则再次达到平衡时c(CH3OH) ="1.5" mol/L
B.达到平衡时,氢气的转化率为0.75
C.0~10分钟内,氢气的平均反应速率为0.075mol/(L?min)
D.该温度下,反应的平衡常数的值为3/16
| E.升高温度将使n(CH3OH)/n(CO2)增大
(3)某种脱硫工艺中将烟气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程为 。
(4)电化学降解NO3- 的原理如题22-3图所示。
①电源正极为 (填“A”或“B”),阴极反应式为 。
②若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
参考答案:(1)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ?mol-1 (2)①< ②B
(3)12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3
(4)①A, 2NO3-+6H2O+10e-=N2↑+12OH- ②7.2
本题解析:(1)(①+②)÷2可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ?mol-1
(2)① 由甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线可以看出:当升高温度时甲醇的体积分数减小,说明升高温度化学平衡向逆反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应反应移动,逆反应方向是吸热反应,所以正反应为放热反应,所以△H<0.② CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)由图可知:反应的容器容积为1L,当反应进行到10分钟时达到平衡,此时CO2的转化率为0.75. CH3OH的平衡浓度为0.75mol/L.A. 此时若向该容器中再充入1mol CO2和3mol H2,假如平衡不发生移动,由于C(CO2)C(H2)都是原来的2倍,则再次达到平衡时c(CH3OH) ="1.5" mol/L。而实质上这是一个反应前后气体体积不等的可逆反应,增大反应物的浓度,也就增大了压强。增大压强化学平衡向气体体积减小的方向即正反应方向移动。所以当达到新的平衡时c(CH3OH)大于1.5 mol/L。错误。B.由于在反应中CO2和H2是按照1:3关系反应的,投入量也是按照1:3加入的,所以再次达到平衡时,氢气的转化率不变,仍为0.75。正确。C.0~10分钟内,V(CO2)= ΔC/Δt="0.75mol/L÷10min=" 0.075mol/( L?min) .V(H2): V(CO2)=3:1,所以V(H2) ="3" V(CO2)= 3×0.075mol/( L?min) = 0.225mol/( L?min).错误。D.该温度下,反应的平衡常数的值K="{" c(CH3OH)·c(H2O)}÷{ c(CO2)·c3(H2)}=" (0.75×0.75)" ÷{0.25×(3-0.75)3}=0.1975.错误.E.由于该反应的正反应是放热反应,所以升高温度将使平衡逆向移动,n(CH3OH)/n(CO2)减小。错误。正确选项为B。(3)该反应的化学方程为12NH3+3O2+4SO2+ 4NO2+6H2O= 4(NH4)2SO4+4NH4NO3(4)① 由于NO3- →N2 ,得到电子,所以应该接电源的负极,作阴极。即A为电源的正极,B为电源的负极。阴极反应式为2NO3-+10e-+6H2O=N2↑+12OH-。② 电解池右侧NO3-转化成N2,发生还原反应:2 NO3-+10e-+6H2O = N2↑+ 12OH- ,其电极应为阴极,则左侧发生 氧化反应:2H2O
本题难度:困难
2、简答题 (12分)锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
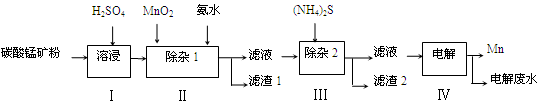
已知25℃,部分物质的溶度积常数如下:
物质
| Mn(OH)2
| Co(OH)2
| Ni(OH)2
| MnS
| CoS
| NiS
| Ksp
| 2.1×10-13
| 3.0×10-16
| 5.0×10-16
| 1.0×10-11
| 5.0×10-22
| 1.0×10-22
|
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 。
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③ 。
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是 ,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(4)步骤Ⅲ中,滤渣2的主要成分是 。
(5)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(6)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥ mol·L-1。
参考答案:(12分)
(1)MnCO3+H2SO4 =MnSO4+ CO2↑+H2O (2分,气体符号不扣分)
(2)抑制Mn2+的水解 (2分)
(3)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O(2分)
(4)CoS和NiS (每个1分,共2分)
(5)阴(1分) Mn2++2e-=Mn(1分) (6)1×10-6 mol/L (2分)
本题解析:(1)碳酸锰与硫酸反应生成硫酸锰、二氧化碳和水,所以化学方程式是MnCO3+H2SO4 =MnSO4+ CO2↑+H2O;
(2)根据表中数据可知氢氧化锰是弱碱,所以硫酸锰水解生成氢氧化锰和硫酸,则硫酸过量的第三个作用是抑制锰离子水解;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,二氧化锰被还原为锰离子,离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)根据流程图可知,除杂1时,将铁离子除去,则除杂2的目的是除去镍离子和钴离子,根据沉淀的溶度积可知,加入硫化铵后,镍离子和钴离子已硫化物的沉淀除去,所以滤渣2的主要成分是CoS和NiS;
(5)电解时,锰离子在阴极发生还原反应,所以Mn在阴极析出;电极反应式是Mn2++2e-=Mn;
(6)因为KMnS=1.0×10-11,所以欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥KMnS/ c(Mn2+)=1×10-6 mol/L。
考点:考查对工业流程的分析,溶度积的应用,离子方程式的书写
本题难度:困难
3、选择题 以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是
A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程
B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
C.电镀时保持电流恒定,升高温度不改变电解反应速率
D.镀锌层破损后对铁制品失去保护作用
参考答案:C
本题解析:电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极,用含有镀层金属离子的溶液作电镀液。因此在铁制品上镀锌时,铁作阴极,锌作阳极,由于锌比铁活泼,因此未通电前可以构成原电池,但此时锌作负极失去电子,铁作正极,而电镀是锌仍然失电子,所以选项A不正确;在氧化还原反应中必需满足得失电子守恒,因此电镀时通过的电量与锌的析出量有确定关系而与能量变化无关,B不正确;由于电镀时保持电流恒定,因此导线中通过的电子速率是不变的,所以升高温度不能改变电解反应速率,C正确;镀锌层破损后,由于锌比铁活泼,所以即使发生电化学腐蚀也是锌失去电子而保护了铁,即选项D也不正确。
本题难度:一般
4、填空题 按照下图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行)
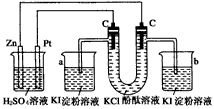
(1)U形管内发生什么现象?__________________________________
(2)写出有关反应的化学方程式。__________________________________
(3)在a、b烧杯中发生什么现象?__________________________________
(4)如果小烧杯中有0.508 g碘析出,问大烧杯中负极减轻多少?
参考答案:(1)左侧管内有黄绿色气体逸出,右侧管内有无色气体逸出,右侧溶液由无色变为红色
(2)Zn+H2SO4=ZnSO4+H2↑、2KCl+2H2O H2↑+Cl2↑+2KOH、2KI+Cl2==2KCl+I2 H2↑+Cl2↑+2KOH、2KI+Cl2==2KCl+I2
(3)a烧杯中的溶液变蓝,b烧杯中有无色气体生成,溶液无明显变化
(4)0.13g
本题解析:
本题难度:一般
5、选择题 电化学降解NO3-的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为a克,则a值为

A.14.4
B.10.4
C.12.4
D.14.0
|