微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在电解水时,为了增强导电性,加入的电解质最好选用( )
A.Na2SO4
B.HCl
C.NaCl
D.CuSO4
参考答案:A.加入Na2SO4,增大溶液浓度,导电性增强,且不影响H2和O2的生成,故A正确;
B.加入HCl,一极析出氢气,另一极产生氯气,影响氧气的生成,故B错误;
C.加入NaCl,发生2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑,生成氯气,不全部为水的电解,故C错误;
D.加入CuSO4,在阴极上析出铜,影响氢气的生成,不全部为水的电解,故D错误.
故选A.
本题解析:
本题难度:一般
2、填空题 (16分)Ⅰ.已知:
4Na(g)+3CO2(g)=2Na2CO3(l)+C(s,金刚石) △H=-1080.9kJ/mol
4Na(g)+CO2(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol
试写出固体Na2O与固体C(金刚石)反应得到气体Na和液态Na2CO3的热化学方程式 。
Ⅱ.硝基苯甲酸乙酯在OH— 存在下发生水解反应:O2NC6H4COOC2H5+OH-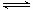 O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示:
t/s
| 0
| 120
| 180
| 240
| 330
| 530
| 600
| 700
| 800
|
α/%
| 0
| 33
| 42
| 49
| 59
| 73
| 74
| 75
| 75
|
回答下列问题:
(1)该反应在330~530s的平均反应速率为 (只列出算式,不做运算)。
(2)试计算某温度下该反应的平衡常数(写出计算过程)。
(3)为提高O2NC6H4COOC2H5的转化率,可以采取的措施有 ,(写2条)。
Ⅲ.(1)下图装置中,开始电解时,Al电极反应式为 ,石墨电极反应式为 。
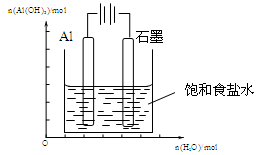
(2)通电一段时间后测得有0.6mol电子转移,作出Al(OH)3物质的量与消耗H2O的物质的量的的图象(反应物足量,作出标注)。
参考答案:Ⅰ.3Na2O(s)+C(s,金刚石) =4Na(g)+Na2CO3(l) △H= —4.2kJ/mol
或6Na2O(s)+2C(s,金刚石) =8Na(g)+2Na2CO3(l) △H= —8.4kJ/mol
(2分,方程式1分,△H的表示1分,状态错误0分;“—”、焓变数值、单位错漏合扣1分)
Ⅱ.
(1) (2分,结果写单位也可,单位错漏扣1分, 计算出结果:3.5×10-5mol/(L.s)也给分,合理即给分)
(2分,结果写单位也可,单位错漏扣1分, 计算出结果:3.5×10-5mol/(L.s)也给分,合理即给分)
(2) O2NC6H4COOC2H5 + OH- 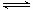 O2NC6H4COO- + C2H5OH
O2NC6H4COO- + C2H5OH
起始浓度(mol/L) 0.050 0.050 0 0
变化浓度(mol/L) 0.050 ×75% 0.050 ×75% 0.050 ×75% 0.050 ×75%
平衡浓度(mol/L) 0.050(1-75%) 0.050(1-75%) 0.050 ×75% 0.050 ×75% (1分)
 (1分)
(1分)  (2分)
(2分)
(共4分,其中:三段式1分,K的表达式1分,代入数值1分,计算结果1分。单位错漏扣1分,全部不带单位不扣分,有效数字错误不扣分,其他合理解法也给分)
(3)升高温度,增大OH-的浓度,移去产物(任答2条,共2分,合理即给分)
Ⅲ.(1)Al-3e-=Al3+或2Al-6e-=2Al3+(2分)
2H2O+2e-=2OH-+H2 ↑或6H2O+6e-=6OH-+3H2 ↑
或 2H++2e-=H2 ↑或 6H++6e-=3H2 ↑(2分)
(2) (2分,其中,曲线1分,标注1分)
(2分,其中,曲线1分,标注1分)
本题解析:Ⅰ 由盖斯定律可知:固体Na2O与固体C(金刚石)反应得到气体Na和液态Na2CO3的热化学方程式:3Na2O(s)+C(s,金刚石) =4Na(g)+Na2CO3(l) △H= -3/2×(-357.5kJ/mol)+1/2(-1080.9kJ/mol)= —4.2kJ/mol;Ⅱ、(1)根据速率公式: ,该反应在330~530s的平均反应速率为
,该反应在330~530s的平均反应速率为 mol/(L.s);(2)试计算某温度下该反应的平衡常数,由题意可知: O2NC6H4COOC2H5 + OH-
mol/(L.s);(2)试计算某温度下该反应的平衡常数,由题意可知: O2NC6H4COOC2H5 + OH- 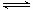 O2NC6H4COO- + C2H5OH
O2NC6H4COO- + C2H5OH
起始浓度(mol/L) 0.050 0.050 0 0
变化浓度(mol/L) 0.050 ×75% 0.050 ×75% 0.050 ×75% 0.050 ×75%
平衡浓度(mol/L) 0.050(1-75%) 0.050(1-75%) 0.050 ×75% 0.050 ×75%
则K= ;(3)为提高O2NC6H4COOC2H5的转化率,即应是平衡正向移动,O2NC6H4COOC2H5+OH-
;(3)为提高O2NC6H4COOC2H5的转化率,即应是平衡正向移动,O2NC6H4COOC2H5+OH-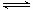 O2NC6H4COO-+C2H5OH为水解反应是吸热反应,故升高温度平衡正向移动,或增大OH-浓度使平衡正向移动增大O2NC6H4COOC2H5的转化率,或分离出乙醇等产物也能使平衡正向移动,故应采取条件为:升高温度或增大OH-浓度或分离出一部分产物;Ⅲ.(1)图装置中,Al电极为阳极,故该电极为Al放电,发生电极反应为2Al-6e-=2Al3+,阴极为水中H+放电,故电极反应为:6H++6e-=3H2 ↑或6H2O+6e-=6OH-+3H2 ↑;(2)通电一段时间后测得有0.6mol电子转移,则消耗水为0.6mol,产生Al(OH)3为0.2mol,故图象为:
O2NC6H4COO-+C2H5OH为水解反应是吸热反应,故升高温度平衡正向移动,或增大OH-浓度使平衡正向移动增大O2NC6H4COOC2H5的转化率,或分离出乙醇等产物也能使平衡正向移动,故应采取条件为:升高温度或增大OH-浓度或分离出一部分产物;Ⅲ.(1)图装置中,Al电极为阳极,故该电极为Al放电,发生电极反应为2Al-6e-=2Al3+,阴极为水中H+放电,故电极反应为:6H++6e-=3H2 ↑或6H2O+6e-=6OH-+3H2 ↑;(2)通电一段时间后测得有0.6mol电子转移,则消耗水为0.6mol,产生Al(OH)3为0.2mol,故图象为: 。
。
考点:化学反应原理综合。
本题难度:困难
3、选择题 用惰性电极电解下列溶液一段时间后再加入一定量的某种纯净物(方括号内物质),能使溶液恢复到原来的成分和浓度的是
A.AgNO3[AgNO3]
B.NaOH[NaOH]
C.KCl[KCl]
D.CuSO4[CuO]