微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100?g?5.00%的NaOH溶液、足量的CuSO4溶液和100?g?10.00%的K2SO4溶液,电极均为石墨电极。?
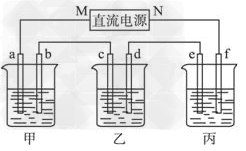
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为___________极;
②电极b上发生的电极反应为________________;
③电极b上生成的气体在标准状况下的体积:_____________________;
④电极c的质量变化是__________g; ⑤电解前后各溶液的pH值的变化(填“不变”、“变大”或“变小”)甲溶液________,乙溶液________,丙溶液________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? ____________________________________________________________。
参考答案:(1)①正;②4OH--4e-=O2↑+2H2O;③2.8 L;④16;⑤甲变大;乙减小;丙不变
(2)若Cu全部析出,溶液为稀硫酸,电解仍然继续进行
本题解析:
本题难度:一般
2、选择题 将铝制品与铁棒作电极,以NaHCO3溶液作电解液进行电解,通电后在铝制品与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电解液从小孔通过并产生热量,使氢氧化铝分解,从而在铝制品表面形成一层较厚的氧化膜.对于这一电解过程中叙述不正确的是( )
A.铝是阳极,铁是阴极
B.使用NaHCO3溶液作为电解液,能减缓阴极区的pH增大
C.电解液必须保持pH的相当稳定
D.该电解过程中阳极反应式是:Al-3e-=Al3+
参考答案:A.阳极较活泼金属失去电子,则铝是阳极,铁是阴极,故A正确;
B.阴极区生成氢氧根离子,由HCO3-+OH-═CO32-+H2O可知,用NaHCO3溶液作为电解液,能减缓阴极区的pH增大,故B正确;
C.电解中产生的Al(OH)3和Al2O3都是两性物质,当电解液呈酸性或强碱性时,刚形成的Al2O3薄膜会被电解液溶解,从而使电解液的pH相当稳定,故C正确;
D.阳极反应为Al-3e-+3HCO3-═Al(OH)3↓+3CO2↑,故D错误;
故选D.
本题解析:
本题难度:简单
3、填空题 某蓄电池因使用日久而正负极标志模糊。请根据另外找到的下列两组器材和试剂,回答两种判断该正负极模糊的蓄电池的正负极的方法。
(1)氯化铜溶液,两根带有铜导线的碳棒:?。
(2)硫酸铜溶液,两根铜导线:?。
参考答案:(1)以两个碳棒为电极组成电解池,电解一段时间后,蓄电池与变红色的碳棒所连接的电极为负极,另一电极为正极
(2)直接以两根铜导线为电极组成电解池,电解一段时间后,蓄电池与逐渐溶解的铜导线相连的电极为正极,另一电极为负极
本题解析:(1)由蓄电池、氯化铜溶液、两根带有铜导线的碳棒可组成一个电解池(两碳棒作电极)。其阳极为惰性电极,电极反应式为2Cl--2e- Cl2↑,阴极的电极反应式为Cu2++2e-
Cl2↑,阴极的电极反应式为Cu2++2e- Cu。还原生成的Cu沉积在阴极的碳棒上而使碳棒显红色。即变紫红色的碳棒为阴极,蓄电池与该阴极相连的电极为负极。(2)由蓄电池、硫酸铜溶液、两根铜导线可组成一个电解池(两根铜导线直接作电极)。其阳极的电极反应式为Cu-2e-
Cu。还原生成的Cu沉积在阴极的碳棒上而使碳棒显红色。即变紫红色的碳棒为阴极,蓄电池与该阴极相连的电极为负极。(2)由蓄电池、硫酸铜溶液、两根铜导线可组成一个电解池(两根铜导线直接作电极)。其阳极的电极反应式为Cu-2e- Cu2+,阴极的电极反应式为Cu2++2e-
Cu2+,阴极的电极反应式为Cu2++2e- Cu。阳极的电极反应使铜导线逐渐溶解而能表现出与阴极不同的现象。逐渐溶解的铜导线是电解池的阳极,蓄电池与该阳极相连的电极为正极。
Cu。阳极的电极反应使铜导线逐渐溶解而能表现出与阴极不同的现象。逐渐溶解的铜导线是电解池的阳极,蓄电池与该阳极相连的电极为正极。
本题难度:简单
4、选择题 一些科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了氨的电化学合成.该过程N2和H2的转化率远高于现在工业上使用的氨合成法.对于电化学合成氨的有关叙述正确的是
[? ]
A.N2在阴极上被氧化
B.可选用铁作为阳极材料
C.阳极的电极反应式是N2+6e-+6H+===2NH3
D.该过程的总反应式是N2+3H2 2NH3
2NH3
参考答案:D
本题解析:
本题难度:一般
5、选择题& nbsp; 按如图装置进行实验,若下图的x轴表示流入阴极的电子的量,则y轴可表示下述哪些变化(假设电解过程中水分不蒸发)
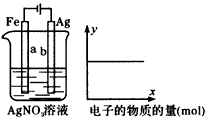
[? ]
①c(Ag+);②c(NO3-);③a棒的质量;④b棒的质量;⑤溶液的pH。
A.①③
B.③④
C.①②④
D.①②⑤
参考答案:D
本题解析:
本题难度:一般