|
高中化学知识点总结《气体的净化、干燥、吸收与收集》高频试题巩固(2017年最新版)(二)
2017-08-06 10:17:48
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)某同学用18 mol/L的浓硫酸配制200mL 0.9mol/L的稀硫酸,并进行有关实验。请回答下列问题:
(1)需要量取浓硫酸? ?mL(准确到小数点后一位)。
(2)配制该稀硫酸时使用的仪器除量筒、烧杯、200mL容量瓶外,还必须用到的仪器有? ?、? ?等。
(3)容量瓶是一种颈部细长的梨形瓶,由于其颈部细长,所以在向容量瓶中移入液体时,需要一定的耐心和技巧。有人建议将容量瓶的瓶颈改粗,对该建议的正确评价是(? )
A.可以按此建议改进,便于使用容量瓶
B.不能按此建议改进,因为会降低容量瓶的精确度
C.如果加粗瓶颈,可将原来刻在容量瓶瓶颈上的刻度线改刻在容量瓶的瓶身上
D.不必加粗瓶颈,因为向容量瓶中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响
| (4)在配制过程中,下列因素对所配制的稀硫酸的物质的量浓度有何影响?
若容量瓶未干燥即用来配制溶液,则所得溶液浓度? 0.9 mol·L-1(填“大于”、“等于”或“小于”,下同);若定容时俯视刻度线,则所得溶液浓度? 0.9 mol·L-1。
参考答案:(共10分) (1)10.0? (2分)
(2)玻璃棒?胶头滴管(可颠倒)。(每空1分)
(3)B(2分)?(4)等于?大于(每空2分)
本题解析:(1)在浓硫酸的稀释过程中,溶质是不变的,所以需要量取浓硫酸的体积是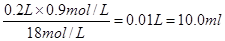 。 。
(2)稀释浓硫酸、向容量瓶中转移硫酸时都需要玻璃棒。另外定容时还需要胶头滴管。
(3)根据容量瓶的结构可知,瓶颈越粗,精确度越低,所以该建议不可取,答案选B。
(4)根据n=c·V可知,如果容量瓶没有干燥,则溶质的溶液的体积不受影响,浓度不变;如果定容时俯视刻度线,则所得溶液的体积偏少,浓度偏高。
点评:该题是高考中的常见题型,属于中等难度的试题。试题侧重考查学生的基础知识,兼顾能力的考查。该题的难度在于误差分析,配制一定物质的量浓度溶液的实验是中学化学中一个重要的定量实验,实验过程中引起溶液浓度存在误差的因素有很多。从大的方面讲,一是由实验过程中的不规范操作引起的;二是由仪器或药品等系统原因引起的。由于引起误差的原因复杂,所以误差分析就成为高考化学实验中的一个难点。
本题难度:一般
2、实验题 (10分) 硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2 ~ 3遍;②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50 ~ 80℃之间至铁屑耗尽;③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水洗涤2 ~ 3次,再用滤纸将晶体吸干;⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。请回答下列问题:
(1)写出Fe2+的核外电子排布式?
(2)用轨道表示式表示Fe3+的3d电子的排布情况?
(3)硫酸亚铁制备中实验步骤①的目的是? ?。
(4)实验步骤②明显不合理,理由是?。
(5)实验步骤④中用少量冰水洗涤晶体,其目的是?。
参考答案:(1)[Ar]3d6?(2)?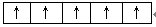 (3)除去铁屑上的油污? (3)除去铁屑上的油污?
(4)Fe不能反应完全,余少部分防止Fe2+被氧化成Fe3+?
(5)?洗涤晶体中混有的稀硫酸,减少洗涤过程中晶体的损耗(2分×5)
本题解析:(1)根据构造原理可写出Fe2+的核外电子排布式为[Ar]3d6。
(2)洪特规则电子总是优先占据1个轨道,并且自旋方向相同,所以Fe3+的3d电子的排布情况是 。 。
(3)碳酸钠溶液显碱性,可以除去铁屑上的油污。
(4)亚铁离子易被氧化生成铁离子,所以必须让铁过量,防止Fe2+被氧化成Fe3+。
(5)晶体表面会吸附溶液中的稀硫酸,所以用水洗涤晶体中混有的稀硫酸,减少洗涤过程中晶体的损耗。
本题难度:一般
3、简答题 (12分)实验室可用干燥纯净的氨还原氧化铜来制取氮气。根据下列装置图(部分夹持装置略去)回答有关问题:
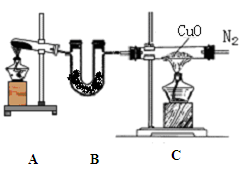
(1)装置B中盛放的药品是?。
(2)写出装置A中反应的化学方程式______?。
(3)写出装置C中反应的化学方程式_________,该反应中的氧化剂是?。
(4)收集到的氮气中除了含有少量水蒸气外,还可能含有另外一种气体,确定是否含有该气体的实验方法是?,实验室收集氮气的方法是?。
参考答案:(1)碱石灰(其它答案合理也可)? (2) Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O CaCl2+2NH3↑+2H2O
(3) 2NH3+3CuO 3Cu+N2↑+3H2O?CuO 3Cu+N2↑+3H2O?CuO
(4)用湿润的红色石蕊试纸靠近玻璃管口,若试纸变蓝色,证明含有该气体?排水集气法
本题解析: 装置A用于制备氨气,用固体制备,Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O ,B装置干燥氨气,只能选择碱石灰,C装置用于制备氮气,2NH3+3CuO CaCl2+2NH3↑+2H2O ,B装置干燥氨气,只能选择碱石灰,C装置用于制备氮气,2NH3+3CuO 3Cu+N2↑+3H2O,氧化剂是CuO,收集到的氮气中有杂质氨气和水蒸气,检验氨气用湿润的红色石蕊试纸靠近玻璃管口,若试纸变蓝色,证明含有氨气,收集氮气用排水集气法。 3Cu+N2↑+3H2O,氧化剂是CuO,收集到的氮气中有杂质氨气和水蒸气,检验氨气用湿润的红色石蕊试纸靠近玻璃管口,若试纸变蓝色,证明含有氨气,收集氮气用排水集气法。
本题难度:一般
4、实验题 (10)按要求完成硝酸钾晶体的制备实验:
步骤
| 操作
| 具体操作步骤
| 现象解释结论等
| ?
①
| 溶解
| 取20克NaNO3和17克KCl溶解在35ml水中,加热至沸,并不断搅拌。
| 固体溶解
| ②
| 蒸发
| 继续加热搅拌,使溶液蒸发浓缩。
| 有?a?晶体析出。
| ③
| 热过滤
| 当溶液体积减少到约原来的一半时,迅速趁热过滤
| 滤液中的最主要成分为?b?。
| ④
| 冷却
| 将滤液冷却至室温。
| 有晶体析出。
|  ⑤ ⑤
| ?
| 按有关要求进行操作
| 得到初产品硝酸钾晶体
| ⑥
| ?
| 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤。
| ?
得到纯度较高的硝酸钾晶体
| ⑦
| ?
检验
| 分别取⑤、⑥得到的产品,配置成溶液后分别加入1滴1mol/l的HNO3和2滴0.1mol/l的AgNO3
| 可观察到⑤、⑥产品中出现的现象分别是⑤产品中产生白色沉淀,⑥产品中无明显现象。
|
(1)把上述各步骤中的内容补充完整:a: b: ?
(2)写出步骤③趁热过滤的目的?,步骤⑥的操作名称?,步骤⑦中产生白色沉淀的离子方程式?
(3)步骤⑥的抽滤装置如图所示,仪器A的名称?,该装置中的错误之处是?;抽滤完毕或中途需停抽滤时,应先?,然后?。
参考答案:(1)NaCl;? KNO3
(2)防止因温度降低而析出硝酸钾晶体;重结晶;Ag++ Cl-= AgCl↓
(3)?布氏漏斗;布氏漏斗的颈口斜面未朝向抽滤瓶的支管口;断开连接安全瓶与抽气装置间的橡皮管;关闭抽气装置的水龙头
本题解析:(1)氯化钠的溶解度小,蒸发浓缩首先写出氯化钠,即a是氯化钠。硝酸钾的溶解度受温度影响大,所以降低温度时氯化钠析出,则b是硝酸钾。
(2)步骤③趁热过滤的目的防止因温度降低而析出硝酸钾晶体。为了得到纯净的硝酸钾晶体,需要重结晶。氯离子能和银离子反应生成氯化银沉淀,方程式为Ag++ Cl-= AgCl↓。
(3)根据仪器结构特点可知,A是布氏漏斗,抽滤时布氏漏斗的颈口斜面未朝向抽滤瓶的支管口,所以该处是错误的。抽滤完毕或中途需停抽滤时,应先断开连接安全瓶与抽气装置间的橡皮管,然后再关闭抽气装置的水龙头。
本题难度:一般
5、实验题 (8分)在实验室制各氯气的实验中:制法
(1)反应原理(方程式)为
(2)实验装置如图所示
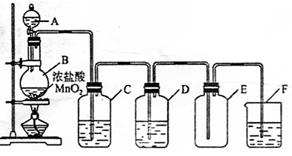
指出下列装置中所盛试剂及其作用:
C.???
D.???
F.???
参考答案:

本题解析:略
本题难度:简单
| 