|
高考化学必考知识点《硫及其化合物》考点特训(2017年冲刺版)(十)
2017-08-06 10:26:36
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分) 硫酸的消费量是衡量一个国家化工生产水平的重要标志。
(1)V2O5是SO2与O2反应的催化剂,请写出该反应的方程式:
_____________________________________________________________________。
(2)一定条件下,SO2与空气反应10 min后,SO2和SO3物质的量浓度分别为1.2 mol/L和2.0 mol/L,则SO2起始物质的量浓度为_____________;生成SO3的化学反应速率为_________________。
(3)若改变外界条件,发生SO2与空气反应生成SO3,使10 min内的用O2表示的反应速率为0.15mol/(L·min),则改变的条件可能是_______________。
A.压缩体积,增大压强
B.降低温度
C.充入大量的氮气
D.仅增加SO2的浓度
| (4)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的离子方程式
______________________________________________________。
参考答案:(10分) (1) 2SO2 + O2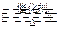 2SO3(2分) 2SO3(2分)
(2) 3.2 mol/L? 0.2 mol/(L·min)(各2分)
(3) A D(2分)
(4) SO2 + 2NH3·H2O = 2NH4++ SO32-+ H2O(2分)
本题解析:略
本题难度:简单
2、计算题 含FeS265%的硫铁矿在煅烧时有1.8%的硫损失而混入炉渣,二氧化硫转化为三氧化硫的利用率为99%。由这种硫铁矿制2t98%的硫酸,需硫铁矿多少吨?
参考答案:设需这种硫铁矿的质量为x。
FeS2 2H2SO4 2H2SO4
x? 2×98
x×65%(1-1.8%)×99%? 2t×98%
x=189.9t
本题解析:通过本题的计算进一步掌握物质纯度,转化率、产率的计算关系式,并在多步反应中找出量的相当式进行简捷的计算。
题中65%为硫铁矿的纯度,有1.8%的硫损失也即是1.8%的FeS2损失,二氧化硫的利用率(转化率)也即是FeS2的利用率。设需这种硫铁矿的质量为x。
解法一: FeS2 2H2SO4 2H2SO4
2×98
x×65%(1-1.8%)×99%? 2t×98%? x=189.9t
解法二:S H2SO4 H2SO4
32? 98
64/120x×65%×(1-1.8%)×99%?2t×98%? x=189.9t
确定关系式的关键是根据硫元素守恒。要注意运用某一种化合物中元素的损失率=该化合物的损失率。另外,耗损和利用率、产率和纯度的关系要处理正确。关系式多用于工业生产中的计算题。
本题难度:一般
3、填空题 某溶液中可能含有Cl-、I-、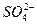 、 、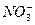 、 、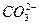 、 、 ,现进行如下实验: ,现进行如下实验:
(1)取部分溶液,加入过量Ba(NO3)2溶液,有白色沉淀生成,过滤出的沉淀部分溶于稀HNO3,并放出气体。
(2)取部分滤液,加入过量NaOH溶液,无沉淀产生。
(3)取部分滤液,加入AgNO3溶液,只有黄色沉淀生成。
根据上述现象,试判断:溶液中肯定存在的离子是____________,肯定不存在的离子是____________,可能存在的离子是____________。
参考答案: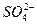 、 、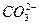 、I-? Cl-、 、I-? Cl-、 ? ?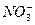
本题解析:由(1)生成的沉淀部分溶于稀HNO3,可知一定含有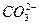 、 、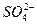 ;由(2)加入NaOH溶液,若有 ;由(2)加入NaOH溶液,若有 ,则转化为 ,则转化为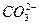 ,与Ba2+生成沉淀,但实际无此现象,说明无 ,与Ba2+生成沉淀,但实际无此现象,说明无 ;由(3)只生成黄色沉淀,可知溶液含I-而不含Cl-。整个过程对 ;由(3)只生成黄色沉淀,可知溶液含I-而不含Cl-。整个过程对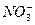 无检验,不能判断它是否存在。 无检验,不能判断它是否存在。
本题难度:简单
4、选择题 下列说法正确的是
A.SO2能使FeCl3、KMnO4溶液褪色
B.用澄清石灰水可鉴别CO2和SO2
C.S在O2中燃烧可生成SO3
D.SO2通入BaCl2溶液中能产生白色沉淀
参考答案:A
本题解析:A:两者均可被SO2还原;B:澄清石灰水与CO2和SO2反应均有白色浑浊产生;C:S在氧气中燃烧生成的产物为SO2;D:SO2与BaCl2不能反应(违反了强酸制弱酸的规律)
本题难度:一般
5、实验题 资料显示:在煤中加入适量石灰石粉可使煤(含S)燃烧时产生的SO2转化成固体CaSO4 ,从而减少SO2排放,该方法被称为钙基固硫。这一过程是通过以下两步反应实现的:
㈠ CaCO3 CaO+CO2 ?㈡ 2CaO+2SO2+O2 =2CaSO4 CaO+CO2 ?㈡ 2CaO+2SO2+O2 =2CaSO4
对此,某实验小组利用下列实验装置和药品对其可行性进行了模拟探究。

已知实验所用样品:Ⅰ---S粉与CaCO3粉末的混合物
Ⅱ---CaSO4粉末
(1)实验一:①取样品Ⅰ装入A中。连续通入过量O2,加热至500℃左右,充分反应发现,B中红色消失、C中出现大量白色浑浊。停止该步实验的正确操作是?。
②取反应后D中溶液滴加过量盐酸,无明显现象。由此得知实验一过程中: A中发生反应的化学方程式是?;C中反应的离子方程式是?。
③要获得与以上实验事实相一致的结论,可替代B中品红溶液的是?。
a.酚酞的NH3·H2O溶液? b.酸性KMnO4溶液
c.酚酞的NaHCO3溶液? d.Br2的CCl4溶液
(2)实验二:①取样品Ⅰ装入A中。连续通入过量O2,并迅速加热升温,控制在1000℃左右,充分反应。发现B中红色消失,C中出现白色浑浊。
②取反应后D中溶液滴加过量盐酸,出现大量无色气泡,反应的离子方程式是??。
③反应结束后,将A中余下固体溶入水中,取其上层清液,滴加BaCl2溶液,立即有白色沉淀出现。
由此得知实验二: A中发生的反应有?(填选 “㈠”、“㈡”)。
(3)实验三:取样品Ⅱ装入A中。连续通入过量O2,加热至1200℃左右,充分反应,B中红色消失,则A中发生反应的化学方程式是?。比较实验一、二、三可知,如用该方法固硫,可行的基本条件是?。
(4)在中学化学实验室里,装置A通常只能选?为材料制作的玻璃管,但这种选择有一点不妥,其理由用化学方程式解释是:?。
(5)实验所需O2若改由空气提供,且对上述实验探究事实不产生影响,应在A前添加一装有某药品的装置。请将该药品和装置图示在图中的虚线框内。
参考答案:①?撤掉喷灯,继续通入O2至A冷却
②? S +O2? ?SO2? 2SO2+2H2O+O2+2Ba2+=2BaSO4↓+4H+? ?SO2? 2SO2+2H2O+O2+2Ba2+=2BaSO4↓+4H+?
③? a、b(2)②? CO32-+2H+=CO2 ↑+H2O③?(一)、(二)
(3)2CaSO4 2CaO+2SO2↑+O2 ↑ 燃烧温度需1000℃左右 2CaO+2SO2↑+O2 ↑ 燃烧温度需1000℃左右
(4)石英?,? SiO2+CaO  CaSiO3(2分) CaSiO3(2分)
(5)图略(装置+药品)
本题解析:(1)实验一:①取S粉与CaCO3粉末的混合物高温灼烧,有SO2产生,C中产生硫酸钡沉淀,D用来吸收过量的SO2,停止实验时,为了避免倒吸,撤掉酒精喷灯以后,要持续通氧气一直到冷却。②取反应后D中溶液滴加过量盐酸,无明显现象,说明没有CO2生成,CaCO3粉末没有分解,只有硫燃烧生成了SO2,C中SO2被氧气氧化产生硫酸钡沉淀,③要获得与以上实验事实相一致的结论,可替代B中品红溶液的用酚酞的NH3·H2O溶液,红色褪去,a正确;b.酸性KMnO4溶液,紫色褪去,正确;c.酚酞的NaHCO3溶液,亚硫酸酸性比碳酸强,会产生CO2,NaOH溶液会吸收CO2,加盐酸有气体产生,错误;d.Br2的CCl4溶液,与SO2不反应,无现象,错误。(2)实验二控制温度在1000℃左右,CaCO3粉末分解,硫燃烧生成了SO2,D中溶液吸收CO2,产生碳酸盐,加入盐酸有大量气泡。(3)实验三:取样品CaSO4粉末装入A中。连续通入过量O2,加热至1200℃左右,充分反应,B中红色消失,说明CaSO4分解,有SO2生成,因此用此方法固硫时,温度应选择实验二的温度,过低CaCO3粉末没有分解,过高CaSO4分解又有SO2生成,不能起到固硫的作用。(4)在中学化学实验室里,装置A通常选择石英材料,但是SiO2和CaO在高温下会反应。(5)实验所需O2若改由空气提供,且对上述实验探究事实不产生影响,应在A前添加一装有NaOH的洗气瓶,除去空气中的CO2。
本题难度:困难
|