微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 SCl2熔点为—78℃,沸点为59℃。若0.2mol SCln与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀。下列判断错误的是
A.n =" 2"
B.SCln中每个原子最外层均满足8电子稳定结构
C.SCln在固态时为分子晶体
D.SCln溶于水能电离出Cl--
参考答案:D
本题解析:略
本题难度:一般
2、选择题 向某溶液中加入BaCl2溶液,再加入稀硝酸,产生的白色沉淀不消失,下列叙述正确的是(?)
A.溶液中一定含有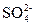
B.溶液中一定含有Ag+
C.溶液中一定含有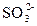
D.溶液中可能含有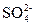 、
、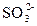 、Ag+中的某一种、两种或三种
、Ag+中的某一种、两种或三种
参考答案:D
本题解析:BaCl2溶液中的Cl-可与Ag+产生不溶于稀硝酸的白色沉淀AgCl;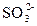 遇到稀HNO3会将其氧化成
遇到稀HNO3会将其氧化成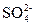 ,所以溶液中如果含有
,所以溶液中如果含有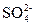 、
、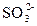 、Ag+中的某一种、两种或三种都会产生上述现象。
、Ag+中的某一种、两种或三种都会产生上述现象。
本题难度:简单
3、填空题 (10分)过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。根据下列
反应回答问题:
A.Na2O2+2HCl=2NaCl+H2O2?
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)上述反应中,H2O2仅体现氧化性的反应是(填代号,下同)?,H2O2既体现氧化性又体现还原性的反应是?,H2O2体现酸性的反应是?。
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是?。
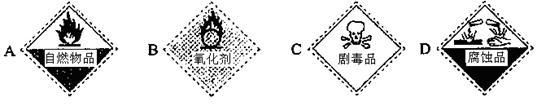
(3)保存过氧化氢试剂瓶上的最适合贴上的一个标签是?(填序号);
(4)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。
①反应体系选择的酸是:?(填序号)。
A.盐酸? B.浓硫酸? C.稀硫酸? D.醋酸
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子为?mol。
(5)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的
氰化物(如KCN),经以下反应:KCN+H2O2+H2O=A+NH3↑,试指出生成物A的化学式为?,并阐明H2O2被称为绿色氧化剂的理由是?。
参考答案:(1)D C A?(2)Ag2O>H2O2>K2C rO4?
rO4?
(3)B?(4)C、0.6
(5)KHCO3,H2O2是氧化剂,其产物是H2O;H2O没有毒性及污染性
本题解析:略
本题难度:简单
4、填空题 亚硫酸钠中的+4价硫,既有氧化性,又有还原性。现有试剂:溴水、Na2S溶液、 Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有_____,看到的现象是___________________________________。
反应的离子方程式为:_______________________。
(2)要证明Na2SO3具有氧化性,应选用的试剂有_____,看到的现象是___________________________________。
反应的离子方程式为:_______________________。
参考答案:(1)溴水、Na2SO3溶液 溴水颜色逐渐褪去? SO32-+Br2+H2O=SO42-+2Br-+2H+
(2)Na2S溶液、Na2SO3溶液、稀硫酸?有淡黄色的沉淀生成? SO32-+2S2-+6H+=3S↓+3H2O
本题解析:要证明Na2SO3具有还原性,只能选择氧化剂溴水,且溴水会褪色;要证明Na2SO3具有氧化性,应选用还原剂Na2S溶液,并选择稀硫酸作为酸性介质。
本题难度:一般
5、选择题 将一张浸湿了溴水的滤纸挂在SO2气体中,滤纸会由黄色变成白色,这主要是因为(?)
A.SO2漂白了滤纸
B.SO2与Br2化合生成了无色的物质
C.反应放热使溴挥发了
D.Br2被SO2还原成无色的Br-
参考答案:D
本题解析:略
本题难度:简单