微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某校化学兴趣小组的同学为研究铜与浓硫酸的反应,分别设计了如下图所示的三套实验装置:

(1)该小组同学对这三套装置进行了评价,认为甲和乙装置各有优缺点,甲装置的优点是?,乙装置的优点是?。
(2)丙装置综合了甲和乙的优点,是一套比较合理的装置,试管C中是?溶液,A中玻璃管可起到防止B中品红溶液倒吸的作用,其原理是?。
为使装置中残留气体完全被C溶液吸收,可采取的操作是?。
(3)写出丙装置中发生反应的化学方程式:?,该小组同学用丙装置进行实验过程中发现除了课本上描述的实验现象外,试管A内还生成了白色固体,白色固体成分可能是?。
参考答案:
(1)有尾气处理措施 (1分);
将铜片改为铜丝,溶液中插入铜丝反应开始,抽出铜丝反应停止,节约药品或“控制反应的进行”(合理描述均给分,1分)
(2)NaOH(或KMnO4等)(1分);玻璃管可平衡内外气压,A中气压不会减小(1分)?;从玻璃管口处鼓入大量空气(1分)
(3)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(2分)?无水硫酸铜(1分)
CuSO4+SO2↑+2H2O(2分)?无水硫酸铜(1分)
本题解析:根据题意:(1)有尾气处理措施;将铜片改为铜丝,溶液中插入铜丝反应开始,抽出铜丝反应停止,节约药品或“控制反应的进行”
(2)吸收二氧化硫可以用NaOH(或KMnO4等);玻璃管可平衡内外气压,A中气压不会减小;从玻璃管口处鼓入大量空气
(3)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,结合题中信息可能为无水硫酸铜
CuSO4+SO2↑+2H2O,结合题中信息可能为无水硫酸铜
本题难度:一般
2、选择题 下列反应中,浓硫酸表现出强氧化性的是
①用铁槽车盛装浓硫酸?②铜片与浓硫酸共热制备SO2
③将含水蒸气的氯气通过盛浓硫酸的洗气瓶
④浓硫酸吸收NH3?⑤浓硫酸使蔗糖炭化时有刺激性气体产生
A.①②④
B.③④⑤
C.①②⑤
D.②⑤
参考答案:C
本题解析:得到电子,化合价降低,物质才能表现出氧化性。铁和浓硫酸发生钝化,但钝化是化学变化,①可以说明;②中有SO2生成,S元素的化合价降低,可以说明;③是浓硫酸的吸水性;④是浓硫酸的酸性;⑤中也有SO2生成,可以说明,答案选C。
点评:浓硫酸和稀硫酸相比具有自身的三大特性,即吸水性、脱水性和强氧化性,需要学生熟练掌握,并能灵活运用。
本题难度:简单
3、计算题 两份不同浓度的NaOH溶液各500mL,分别吸收1120mL(标准状况下体积)SO2气体,反应后溶液中分别有5.75g和7.10g溶质。求两份NaOH溶液的物质的量浓度。
参考答案:0.150mol/L、0.240mol/L。
本题解析:解答本题时,一要挖掘隐含的两个反应;二要运用平均值规律通过对“5.75g”和“7.10g”的量的分析,判断溶质的组成。
SO2与NaOH作用可能的反应有:
SO2+2NaOH=Na2SO3+H2O;SO2+NaOH=NaHSO3。
1120mLSO2气体可生成0.0500molNa2SO3或NaHSO3,质量是6.30g或5.20g。依题意,两份溶液中,含溶质5.75g的一定含Na2SO3和NaHSO3;含溶质7.10g的一定含Na2SO3和NaOH。
设第一份溶液中含Na2SO3物质的量为x,NaHSO3物质的量为y,则:
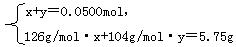
解得? x=0.0250mol,y=0.0250mol。
原溶液中含NaOH物质的量为:
2x+y=0.0750mol,
c(NaOH)=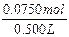 =0.150mol/L。
=0.150mol/L。
依上分析,第二份溶液中含Na2SO30.0500mol,质量是6.30g,则含NaOH的质量为:m(NaOH)=7.10g-6.30g=0.80g。
原溶液中含NaOH物质的量为:
2×0.0500mol+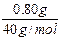 =0.120mol,
=0.120mol,
c(NaOH)=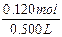 =0.240mol/L。
=0.240mol/L。
本题难度:简单
4、选择题 把1 g含脉石(SiO2)的黄铁矿样品放在O2流中灼烧,反应完全后得到残渣0.78 g,则此黄铁矿的纯度是…()
A.33%
B.66%
C.78%
D.88%
参考答案:B
本题解析:利用差量法求解。
4FeS2+11O2 2Fe2O3+8SO2 ~Δm
2Fe2O3+8SO2 ~Δm
4×120? 160
m(FeS2)? 1 g-0.78 g
m(FeS2)="0.66" g
FeS2的纯度为: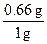 ×100%=66%
×100%=66%
本题难度:简单
5、选择题 下表所列举的各组事实中,存在因果关系的是
A.A
B.B
C.C
D.D
参考答案:D
本题解析:分析:A、从工业生产硫酸用浓硫酸吸收分析;
B、从氯气和二氧化硫的性质分析,混合通入水溶液中反应;
C、从金属性的强弱取决于失电子的能力分析;
D、从石墨的化学性质和导电性分析.
解答:A、三氧化硫易和水反应,但在工业制硫酸中用水吸收三氧化硫易形成酸雾,阻止吸收,所以用98.3%的浓硫酸吸收三氧化硫,无因果关系,故A不选;
B、氯气与水反应生成的次氯酸有漂白作用,二氧化硫有漂白作用,但二者在水的作用下反应生成生成硫酸和盐酸,Cl2+SO2+2H2O=H2SO4+2HCl,Cl2和SO2混合后不能用于漂白纸浆,无因果关系,故B不选;
C、金属性的强弱是由失电子能力决定的,钠失电子能力强于铝,所以钠的金属性强于铝,与铝最外层电子数多无关,无因果关系,故C不选;
D、石墨具有良好的导电性,化学性质稳定一般不发生反应,可以做电解池中的电极,所以前后有因果关系,有因果关系,故D选;
故选D.
点评:本题主要考查物质的性质和用途,解答时要充分理解各种物质的性质,然后再根据物质的性质方面进行分析、判断,从而确定物质的用途.
本题难度:困难