微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256kJ的热量。
①写出该反应的热化学方程式 。
②又已知H2O(l) = H2O(g),△H = 44 kJ/mol,则16g液态肼与液态双氧水反应生成液态水时放出的热量是
______________kJ。
(2)实验室用足量的金属锌与体积、浓度一定的稀硫酸反应制取氢气时(不考虑温度变化),要想使反应速率减慢,又不影响产生氢气的总量,下列措施中能达到目的的是_______________。
①加入少量固体碳酸钠;
②加入少量固体醋酸钠;
③加入适量的硫酸钠溶液;
④加入适量的硝酸钠溶液;
⑤滴加少量CuSO4溶液;
⑥加热
参考答案:(1)① N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H = -640kJ/mol;②408
(2)②③
本题解析:
本题难度:一般
2、填空题 ?某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是________________
(2)实验室中现有Na2SO4、CuCl2、MgSO4、K2SO4等4种溶液,可与上述实验中CuSO4
溶液起相似作用的是________;
(3)要加快上述实验中气体产生的速率,还可采取的措施有________________(答两种)
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,
收集产生的气体,记录获得相同体积的气体所需时间。
实验
混合溶液
| ? A
| ? B
| ? C
| ? D
| ? E
| ? F
|
4mol/L ?H2SO?4/mL
| ? 30
| ? V1
| ?V2
| ? V3
| ? V4
| ? V5
|
饱和CuSO4溶液? /mL
| ? 0
| ? 0.5
| ? 2.5
| ? 5
| ? V6
| ? 20
|
H2O? /mL
| ? V7
| ? V8
| ? V9
| ? V10
| ? 10
| ? 0
|
①请完成此实验设计,其中:V1=?,V6=?,V9=?;
②?该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因?
参考答案:(1) CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn微电池,加快了氢气产生的速率? (2分)?
(2)? CuCl2、(1分)
(3)升高反应温度、适当增大硫酸的浓度、或增加锌的比表面积等(2分)
(4)①30 10 17.5 (3分)
②当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积(2分)
本题解析:CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn微电池,加快了氢气产生的速率,因此能起到相似作用的应该是含有铜离子的,所以为氯化铜。影响化学反应速率的因素有,温度,催化剂,浓度,压强,反应物的接触面积。AB应比较的是硫酸铜溶液对该反应的影响。因此硫酸的量应与A的相同,所以V1=30?据表格可知,CDEF应该是呈两倍的关系递增,所以V6="10" 。从图表可知饱和硫酸铜的体积与水的体积之和应为20毫升。所以V9应为20减去2.5等于17.5. :当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降主要是由于当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积
本题难度:一般
3、填空题 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法研究反应速率的有关问题。
(1)实验1?探究Mg与盐酸反应速率的变化规律

取一段镁条,用砂纸擦去表面的氧化膜,铜丝缠着镁条伸入装置甲中,使镁条浸入锥形瓶内的体积为2L稀盐酸(足量)中。镁条和盐酸反应生成H2的体积与反应时间的关系曲线如图2所示。
① 从图2中看出0-6min内平均反应速率最快的时间段是?。(填代号)
A.0-2min?B.2-4min? C.4-6min
② 请计算4-6min 时间内,用HCl表示的平均反应速率为________。(假设图2氢气体积均已换算为标准状况下的体积,且溶液体积变化可忽略)
③图1装置甲中与镁条相连的铜丝若一起浸入稀盐酸中对反应速率影响下列说法正确的是
A.加快反应速率但生成氢气的总量不变?B.减慢反应但增大生成氢气总量?
C.不影响反应速率? D.加快反应速率但生成氢气的总量减小
(2)实验2?探究酸浓度对MnO2与H2O2反应速率的影响
已知MnO2+H2O2+2H+?Mn2++O2↑+2H2O,现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0 mL氧气所需时间。
实验编号
| Ⅰ
| Ⅱ
| Ⅲ
| Ⅳ
|
10%H2O2的体积/mL
| 5.0
| 5.0
| V1
| V2
|
20%硫酸的体积/mL
| 0
| 0.5
| 1.0
| V3
|
水的体积/mL
| 15
| 14.5
| V4
| 13.5
|
所需时间t/s
| t1
| t2
| t3
| t4
|
①上表中V1=?mL, V3=?mL。
②有同学提出实验I不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是?。
③若实验测得t2>t3>t4,则可得出的实验结论是?。
参考答案:(10分)(1)① B(1分)② 0.1mol/(L·min)(2分,单位没写或写错扣1分)③A(1分)
(2)① 5.0(1分)? 1.5?(1分)? ②实验I中MnO2将作为催化剂,其他三组实验中二氧化锰作氧化剂,反应原理不同,且酸量不同。(只回答没加硫酸无可比性不得分)(2分)
③酸浓度越大,反应速率越快(2分)
本题解析:(1)①反应速率越快,相应曲线的斜率越大,则根据图像可知,反应速率最快的是2-4min内,即答案选B。
②根据图像可知,4-6min内生成氢气的体积是34.48ml-30.00ml=4.48ml,物质的量是0.002mol,所以消耗盐酸的物质的量是0.004mol,则用盐酸表示的反应速率是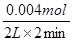 =0.1mol/(L·min)。
=0.1mol/(L·min)。
③与镁条相连的铜丝若一起浸入稀盐酸中,则构成原电池,加快反应速率,但生成氢气的总量不变,所以答案选A。
(2)①要探究酸浓度对MnO2与H2O2反应速率的影响,则双氧水的浓度应该是相等的,所以V1=5ml。又因为最终溶液的体积必须相等,所以V3=20.0ml-13.5ml-5.0ml=1.5ml。
②实验I中MnO2将作为催化剂,其他三组实验中二氧化锰作氧化剂,反应原理不同,且酸量不同,所以实验I不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验。
③若实验测得t2>t3>t4,而实验Ⅱ、Ⅲ、Ⅳ中酸的浓度逐渐增大,这说明酸浓度越大,反应速率越快。
点评:该题是中等难度的试题,试题注重基础,侧重能力的培养和解题方法的指导,有利于培养学生的逻辑思维能力和抽象思维能力,提高学生分析问题、解决问题的能力。
本题难度:困难
4、选择题 下列说法正确的是
[? ]
A.废旧电池应集中回收,并填埋处理
B.充电电池放电时,电能转变为化学能
C.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关
D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行
参考答案:C
本题解析:
本题难度:简单
5、填空题 在一容积固定的反应容器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下: A、 B和C均为4.0mol, D为 6.5mol, F为2.0mol,设E为xmol,x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中间位置。
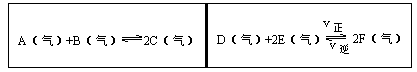
①若x=4.5,则右侧反应在起始时向______方向进行,欲使起始反应维持向该方向进行,则x的取值范围为____ 。
②若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?______,其理由是______。
参考答案:①当x=4.5时,正反应方向,x取值范围为3.5<x<7.0。②不同,理由见解析
本题解析:左侧可逆反应是反应前后气体的物质的量不变的反应,右侧可逆反应的正反应是气体的物质的量缩小的反应。隔板在中间意味着左右两侧可逆反应在一定条件下达到平衡时,气体的物质的量相等。左侧气体的起始量已知,共12mol,
①当x=4.5时,气体总物质的量为13.0mol,欲使右侧反应的总物质的量为12mol,应在起始时向气体体积缩小的方向进行。欲使反应向正反应方向进行,可以通过极端假设的方法来讨论:假设平衡不移动,x="12.0" mol-6.5 mol-2.0 mol=3.5mol;假设平衡向正反应方向移动使E为0 mol,(6.5-0.5x)+(2.0+x)="12.0" mol,x="7.0" mol,故x取值范围为3.5<x<7.0。②当x的取值不同时,反应分别达到平衡的气体总物质的量均为12mol,两个反应的温度肯定不同,所以左侧中的气体A的物质的量也肯定不同。
本题难度:一般