微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有如下两个反应:①E(g)

M(g)+N(g)②A(g)

C(g)+B(g),起始时c(E)>c(A),且①的反应温度高于②(其他条件不变),则两反应的速率大小为( )
A.①>②
B.①<②
C.①=②
D.无法确定
参考答案:化学反应速率是整个过程的平均速率,起始时c(E)>c(A),不能确定化学反应速率的大小,①的反应温度高于②,但是随后发生的化学反应的吸热和放热会引起化学反应中温度的变化,从而导致化学反应速率会发生变化,从另一个角度说,一般比较两个不同的化学反应中的速率意义不大,没有实际意义.
故选D.
本题解析:
本题难度:一般
2、实验题 硫代硫酸钠(Na2S2O3)俗称大苏打,照相业中用作定影剂。Na2S2O3易溶于水,在酸性溶液中与酸反应有单质硫和SO2生成。
(1)Na2S2O3溶液与稀硫酸混合反应可用于探究外界条件对反应速率的影响,完成有关的实验设计表(已知各溶液体积均为5 mL):
实验编号
| T/K
| c(Na2S2O3)/ mol·L-1
| c(H2SO4)/ mol·L-1
| 实验目的
|
①
| 298
| 0.1
| 0.1
| 实验①和②探究温度对该反应速率的影响;
实验①和③探究反应物浓度对该反应速率的影响
|
②
| 308
| ?
| ?
|
③
| ?
| 0.2
| ?
|
(2)Na2S2O3还具有很强的还原性,Na2S2O3溶液与足量氯水反应的化学方程式为:
________??(提示:S元素被氧化为SO42-)。
(3)现有一瓶Na2S2O3固体,可能含有Na2SO4固体,请设计实验验证,写出实验步骤、预期现象和结论。限选试剂:1 mol·L-1 H2SO4、1 mol·L-1 HNO3、1 mol·L-1 HCl、1 mol·L-1 NaOH、0.1 mol·L-1 Ba(NO3)2、0.1 mol·L-1 BaCl2、0.01 mol·L-1 KMnO4、蒸馏水。
实验步骤
| 预期现象和结论
|
步骤1:取少量固体于试管A中,加蒸馏水溶解。
| ?
|
步骤2:向试管A加入?
?
| ?
?
|
步骤3:取步骤2的少量上层清液于试管B中,??
?
| ?
?
|
?
参考答案:(1)表格内每空1分,共4分
实验编号
T/K
c(Na2S2O3)/
mol·L-1
c(H2SO4)/
mol·L-1
①
?
?
?
②
?
0.1
0.1
③
298
?
0.1
(2) Na2S2O3+4Cl2+5H2O = Na2SO4+8HCl+H2SO4(2分,未配平给1分)(或Na2S2O3+4Cl2+5H2O = 2NaCl+6HCl+2H2SO4)
(3)
实验步骤
预期现象和结论
步骤1:取少量固体于试管中,加蒸馏水溶解
?
步骤2:向试管中加入过量1 mol·L-1 HCl溶液,充分振荡,静置(2分)
有淡黄色沉淀生成(2分)
步骤3:取上层清液于另一试管中,滴加少量0.1 mol·L-1BaCl2溶液(2分)
有白色沉淀生成,证明固体中混有Na2SO4(2分)
[或无白色沉淀生成,证明固体中无Na2SO4]
?
步骤2:步骤与现象、结论不株连。未写“过量”扣1分;缺少“充分振荡”扣一分。现象和结论中:刺激性气味气体或气泡产生可给分。
步骤3:无“少量”不扣分,将BaCl2写成Ba(NO3)2的不得分,不株连现象和结论
本题解析:(1)探究影响化学反应速率的因素时,每次只能改变一个条件,①和②温度不同,浓度应该相同,①和③改变了Na2S2O3的浓度,其他条件相同;(2)发生氧化还原反应,结合电子守恒配平;(3)
实验步骤
预期现象和结论
步骤1:取少量固体于试管中,加蒸馏水溶解
?
步骤2:向试管中加入过量1 mol·L-1 HCl溶液,充分振荡,静置(2分)
有淡黄色沉淀生成(2分)
步骤3:取上层清液于另一试管中,滴加少量0.1 mol·L-1BaCl2溶液(2分)
有白色沉淀生成,证明固体中混有Na2SO4(2分)
[或无白色沉淀生成,证明固体中无Na2SO4]
本题难度:一般
3、选择题 可逆反应A(?)+a B(g)
参考答案:
本题解析:
本题难度:一般
4、选择题 在KIO3、KHSO3的酸性混合溶液中,加入少量KI和淀粉,不停地搅拌,有下列反应发生:①I
+5I-+6H+=3I2+3H2O②3I2+3HS+3H2O=6I-+3HS+6H+,总反应为:I+3HSO3=I-+3HS;当反应进行到15min时,溶液突然变为蓝色,随之又很快消失,这一反应称为时钟反应,有人用它来解释生物钟现象.下列有关说法错误的是( )
A.在整个时钟反应过程中,起催化作用的物质是KI
B.上述两个反应中,反应速率较快的是②
C.时钟反应的快慢由反应②决定
D.“溶液突然变为蓝色,随之又很快消失”,这一现象与①②的反应速率有关
参考答案:A.抓住催化剂的主要特征,在反应前后都有,①IO3-+5I-+6H+→3I2+3H2O ②3I2+3HSO3-+3H2O→6I-+3SO42-+9H+,将①×6+②×5得:6IO3-+15HSO3-═15SO42-+3I2+9H++3H2O,KI起催化作用,故A正确;
B.当反应进行到15min时,溶液突然变为蓝色发生反应,发生反应①,随之又很快消失,很快消失说明②的反应速率大于①;
C.反应②为快反应,反应①为慢反应,由反应①决定时钟反应,故C错误;
D.当反应进行到15min时,溶液突然变为蓝色发生反应,发生反应①,随之又很快消失,很快消失说明②的反应速率大于①,现象与①②的反应速率有关,故D正确;
故选C.
本题解析:
本题难度:简单
5、填空题 将除去氧化膜的镁条插入到稀盐酸溶液中,发现生成氢气的速度变化情况如图所示:
其中t1-t2?速度变化的主要原因是
______
t2-t3?速度变化的主要原因是______.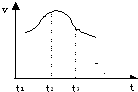
参考答案:由图可知,t1-t2?速度增大,是因该反应为放热反应,随着反应的进行,温度升高,反应速率逐渐加快;
t2-t3?速度减小,是因随着反应的进行,c(HCl)逐渐减小,反应速率逐渐减慢,
故答案为:该反应为放热反应,随着反应的进行,温度升高,反应速率逐渐加快;随着反应的进行,c(HCl)逐渐减小,反应速率逐渐减慢.
本题解析:
本题难度:一般