|
高考化学试题《影响化学反应速率的因素》高频考点预测(2017年最新版)(四)
2017-08-06 10:32:27
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把镁条投入到盛有盐酸的敞口容器中,下列因素对产生H2速率没有影响的是
A.Cl-的浓度
B.镁条的表面积
C.溶液的温度
D.H+的浓度
|
参考答案:A
本题解析:A、镁和盐酸反应过程中氯离子没有参与反应,故氯离子浓度不影响反应速率,选A;B、镁条的表面积影响反应速率,不选B;C、温度对速率有影响,不选C;D、氢离子的浓度大小影响反应速率,不选D。
考点:反应速率的影响因素。
本题难度:一般
2、选择题 下列图示与对应的叙述相符的是( )
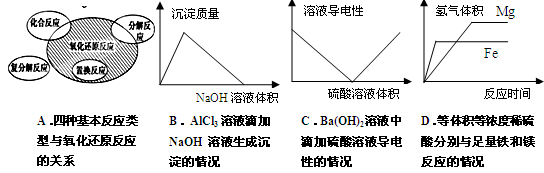
参考答案:A
本题解析:A、根据置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应,化合反应与分解反应不一定是氧化还原反应判断,正确;B、AlCl3溶液中加氢氧化钠溶液发生的反应为
Al3+ + 3OH-=Al(OH)3↓,Al(OH)3 + OH-=AlO2- + 2H2O,生成Al(OH)3沉淀和沉淀溶解所需氢氧化钠溶液的体积比为3:1,与图像不符,错误;C、Ba(OH)2溶液中滴加硫酸溶液发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,溶液中的Ba2+和OH-浓度在减少,导电性会减弱但不会丧失导电性,随着滴加H2SO4逐渐过量,溶液中自由移动离子(H+和SO42-)的浓度增大,导电性会增强,与图像不符,错误;D、等体积等浓度的稀硫酸分别与足量铁和镁反应产生氢气的量相等,镁比铁活泼,镁先反应完,与图像不符,错误。
考点:以图像、图形为载体考查基本概念和相关物质的性质。
本题难度:一般
3、填空题 已知草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。
(1)草酸的电离方程式为 。
(2)将草酸溶液与酸性高锰酸钾溶液混合发生的反应为:
MnO4-+ H2C2O4+ → Mn2+ + CO2↑+ H2O
某合作小组同学在烧杯中进行上述反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
①配平上述离子方程式
②该实验不久后溶液突然褪色的原因最有可能是 。
A.体系压强增大 B.反应物接触面积增大
C.生成物对反应有催化作用 D.反应物浓度增大
(3)为研究该化学反应速率的影响因素,某同学进行了以下实验:
组别
| 温度/℃
| V(H2C2O4)
/mL
| V(KMnO4)
/mL
| V(H2O)
/mL
| KMnO4溶液
褪色时间/s
| 1
| 30
| 10
| 10
| 20
| 40
| 2
| 30
| 20
| 20
| 0
| t
| 3
| 30
|
|
| 15
|
|
①对比实验1和3要研究改变反应物浓度对化学反应速率的影响,请完成表格中横线。
②实验2中溶液褪色时间t 为
A.>40 B.=40 C.<40 D.无法判断
参考答案:(10分)(1)H2C2O4 H++ HC2O4— H++ HC2O4—
(2)①2 5 6 H+ ==2 10 8
②C
(3)①
组别
温度/℃
V(H2C2O4)
/mL
V(KMnO4)
/mL
V(H2O)
/mL
KMnO4溶液
褪色时间/s
1
30
10
10
20
40
2
30
20
20
0
t
3
30
15
10
15
②D
本题解析:(1)草酸(H2C2O4)是一种二元弱酸,电离方程式为H2C2O4 H++ HC2O4—;(2)①根据化合价升降法及元素守恒配平离子方程式为2MnO4-+5H2C2O4+6H+ ==2Mn2++10CO2↑+8H2O ;②溶液突然褪色,说明反应速率突然增大,原因最有可能是催化剂,答案选C;(3)①变量控制,总体积为40ml,加水15ml,与实验1比较,可得答案;②反应不是均速进行,由于生成物有催化作用,无法确定褪色时间,答案选D。 H++ HC2O4—;(2)①根据化合价升降法及元素守恒配平离子方程式为2MnO4-+5H2C2O4+6H+ ==2Mn2++10CO2↑+8H2O ;②溶液突然褪色,说明反应速率突然增大,原因最有可能是催化剂,答案选C;(3)①变量控制,总体积为40ml,加水15ml,与实验1比较,可得答案;②反应不是均速进行,由于生成物有催化作用,无法确定褪色时间,答案选D。
考点:草酸的性质、电离、氧化还原反应、化学反应速率
本题难度:困难
4、实验题 (5分)某实验小组对H2O2的分解做了如下探究:
(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:
用10ml H2O2制取150ml(标准状况下)O2所需的时间(s)
反应条件
时间(s)
反应条件
时间(s)
浓度
|
30%H2O2
|
15%H2O2
|
10%H2O2
|
5%H2O2
| 无催化剂、不加热
| 几乎不反应
| 几乎不反应
| 几乎不反应
| 几乎不反应
| 无催化剂、加热
| 360
| 480
| t
| 720
| MnO2催化剂、加热
| 10
| 25
| 60
| 120
|
①该实验小组在设计方案时,考虑了浓度、 、 等因素对H2O2分解速率的影响。
 ②推测t的范围为 。 ②推测t的范围为 。
(2)将质量相同但聚集状态不同的MnO2分别加入15 ml 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
催化剂(MnO2)
| 操作情况
| 观察结果
| 反应完成所需的时间
| 粉末状
| 混合不振荡
| 剧烈反应,带火星的木条复燃
| 3.5min
| 块状
| 反应较慢,火星红亮但木条未复燃
| 30min
|
①写出上述实验中发生反应的化学方程式:
②实验结果表明,催化剂的催化效果与 有关。
参考答案:(1)①温度、催化剂②480<t<720 ①2H2O2=2H2O+O2↑②催化剂的颗粒大小
本题解析:考查外界条件对反应速率的影响
(1)根据表中的实验数据可判断,在设计实验方案时考虑了浓度、温度和催化剂等对反应速率的影响。因为浓度越大,反应速率越快,所以10%的双氧水分解生成相同的氧气时小于的时间要大于15%的双氧水,而小于5%的双氧水,即480<t<720。
(2)双氧水不稳定,加热分解生成氧气和水,反应式为2H2O2=2H2O+O2↑。根据实验现象可判断粉末状的催化剂催化效果好,这说明催化剂的催化效果与催化剂的颗粒大小有关系。
本题难度:一般
5、填空题 取2g干燥铝粉和3g碘粉小心混匀,分为四堆。往各堆上分别加0.5g水,1g明矾,1g胆矾,1g无水硫酸铜。加水那堆首先冒火花,发生剧烈反应,其次发生反应的是加明矾的老妈子一堆混合物,再次是加胆矾的发生反应,而加无水硫酸铜的那一堆最难发生反应。
(1)铝和碘反应的方程式为_________________________;
(2)铝和碘反应还可看到_______________________;
(3)四堆混合物发生反应的先后顺序说明_________________________。
参考答案:(1)2Al +3I2 ===2AlI3
(2)紫色蒸气
(3)水是催化剂,明矾比胆矾更易失水。
本题解析:
本题难度:一般
|  ②推测t的范围为 。
②推测t的范围为 。