微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)某同学用铁、铜作为电极,稀硫酸作为电解液组成原电池,如图所示,完成下列空格。

(1)正极是 (填“铜极”或“铁极”),现象是: ,电极反应是: ,发生 反应(填“氧化”或“还原”)。
(2)电流从 经导线流到 (填“铜极”或“铁极”)。
(3)若反应生成的氢气在标况下为4.48L,则反应过程中有 mol电子发生转移,溶解的铁质量为 g。
参考答案:(1)铜极、有气泡产生、2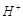 +2
+2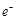 =
=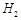 ↑、还原;
↑、还原;
(2)铜极、铁极;(以上每空各1分) (3)0.4(2分)、11.2(2分)
本题解析:考查原电池的应用。原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,不活泼的金属作正极,溶液中的阳离子在正极得到电子,发生还原反应。铁比铜活泼,铁是负极,被氧化生成亚铁离子。铜是正极,溶液中的氢离子在正极得到电子,生成氢气。在标况下4.48L氢气是 ,转移电子是0.2mol×2=0.4mol。则溶解的铁是
,转移电子是0.2mol×2=0.4mol。则溶解的铁是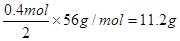 。
。
本题难度:一般
2、填空题 如图所示,将铁、铜通过导线相连,置于稀硫酸中.
(1)铁片上的现象是______,电极反应式______.
(2)铜片上的现象是______,电极反应式______.
(3)写出该电池总反应的离子方程式______.
(4)Fe2+向______(填具体电极)移动,溶液中的pH______(填“变大”或“变小”).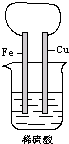
参考答案:(1)该原电池中,铁的活泼性大于铜,铁作负极,铁失电子变成离子进入溶液,所以铁片逐渐溶解,电极反应式为:Fe-2e-=Fe2+;
故答案为:Fe-2e-=Fe2+.
(2)铜作正极,铜电极上,氢离子得电子生成氢气2H++2e-=H2↑,所以看到的现象是:有大量气泡产生.
故答案为:有大量气泡产生;2H++2e-=H2↑.
(3)正负极上电极反应式相加得电池反应式,所以电池反应式为Fe+2H+=Fe2++H2↑;
故答案为:Fe+2H+=Fe2++H2↑.
(4)该电池外电路上,电子从铁片沿导线流向铜片,所以铜片上有大量电子,根据异性电荷相吸,所以
Fe2+向铜极移动,在铜极上氢离子得电子生成氢气,所以氢离子浓度降低,溶液中的pH变大.
故答案为:变大.
本题解析:
本题难度:一般
3、选择题 关于下列各装置图的叙述中,不正确的是( )
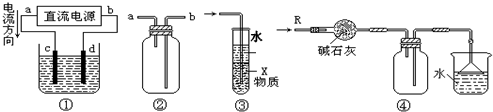
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、CO2、Cl2、HCl、NO2等气体(必要时可添加尾气处理装置)
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并能防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
参考答案:A、根据图片知,电源的正极是a,负极是b,所以电解池的阳极是c,阴极是d,故A错误;
B、H2、CO2、Cl2、HCl、NO2等气体和氧气不反应,所以可以采用排空气法进行收集;H2的密度小于空气密度,所以可以采用向下排空气法进行收集,即导气管“短进长出”,CO2、Cl2、HCl、NO2的密度大于空气的密度,所以可以采用向上排空气法进行收集,即导气管“长进短出”,故B正确;
C、四氯化碳的密度大于水的密度且和水不互溶,所以四氯化碳和水混合会分层,氨气和氯化氢气体极易溶于水,且不溶于四氯化碳,所以四氯化碳有缓冲作用,可以用此装置吸收NH3或HCl,并可防止倒吸,故C正确;
D、碱石灰呈碱性所以能干燥碱性气体氨气,氨气的密度小于空气密度且和氧气不反应,所以可以用向下排空气法收集氨气,氨气极易溶于水,倒置的漏斗有缓冲作用,所以可以用倒置的漏斗吸收氨气,故D正确;
故选A.
本题解析:
本题难度:简单
4、选择题 (附加题)下图是锌片和铜片同时插入稀2.硫酸中所组成的原电池装置,c、d为两个电极。则下列有关的判断正确的是?
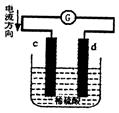
A.d为正极,发生氧化反应
B.c为铜片,铜片上发生还原反应
C.电池工作的过程中,d电极上产生大量的气泡
D.电池工作的过程中,溶液中pH增大
参考答案:CD
本题解析:考查原电池的概念及有关判断。在原电池中较活泼的金属作负极失去电子,被氧化,发生氧化反应。不活泼的金属作正极,负极所失去的电子经导线传递到正极上,所以溶液中的阳离子向正极移动,在正极上得到电子,发生还原反应。所以根据装置图可判断c是负极,d是正极。氢离子在正极上得到电子,发生还原反应生成氢气。所以答案是CD。
本题难度:简单
5、简答题 如图所示,组成的原电池:当电解质溶液为稀H2SO4时:Zn电极是______(填“正”或“负”)极,其电极反应为______,该反应是______(填“氧化”或“还原”,下同)反应;Cu电极是______极,其电极反应为______.

参考答案:该原电池中,锌易失电子作负极,电极反应式为:Zn-2e-═Zn2+,失电子的物质发生氧化反应,铜电极是正极,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-═H2↑,
故答案为:负,Zn-2e-═Zn2+,氧化,正,2H++2e-═H2↑.
本题解析:
本题难度:一般