| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《盐类水解的原理》考点强化练习(2017年押题版)(二)
参考答案:B 本题解析: A.He是单原子分子,所以常温常压下,1 mol氦气含有的电子数目为2NA,错误;B.CH3COONa是强碱弱酸盐,CH3COO-会发生水解反应而消耗。若CH3COONa溶液中CH3COO-的数目为NA,则Na+的数目大于NA,正确;C.一定条件下,1 mol N2和3 mol H2混合发生反应,由于该反应是可逆反应,反应不可能进行到底,所以转移的电子数 目小于6NA,错误;D.标准状况下,己烷的状态是液态,所以不能使用气体摩尔体积来计算,错误。 本题难度:一般 4、选择题 下列溶液中微粒浓度关系不正确的是( ) |
参考答案:AC
本题解析:氨水与氯化铵的混合溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-),常温下溶液pH=7,即c(H+)=c(OH-),所以c(NH4+)=c(Cl-),A项正确;选项B,没有指明酸、碱的强弱,故不能判断溶液的酸碱性,B项错;(NH4)2SO4中NH4+的水解是微弱的(水解显酸性),故0.1 mol·L-1的(NH4)2SO4溶液中:0.1 mol·L-1<c(NH4+)<0.2 mol·L-1,则有c(NH4+)>c(SO42-)>c(H+)>c(OH-),C项正确;硫化钠溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),存在物料守恒:c(Na+)=2[c(HS-)+c(S2-)+c(H2S)],由两式联立可得c(OH-)=c(HS-)+2c(H2S)+c(H+),D项错。
本题难度:困难
5、填空题 (10分)(1)AgNO3的水溶液呈 (填“酸”“中”或“碱”)性,原因是(用离子方程式表示): ;实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”或“抑制”)其水解。
(2)明矾溶于水其中铝离子水解可用于净水,用离子方程式表示:
(3)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示):
参考答案:(1)酸 Ag+ + H2O 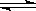 AgOH + H+ 抑制 (2)Al3+ +3H2O
AgOH + H+ 抑制 (2)Al3+ +3H2O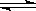 Al(OH)3 +3H+
Al(OH)3 +3H+
(3)CO32- + H2O 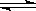 HCO3- +OH-
HCO3- +OH-
本题解析:(1)AgNO3是强酸弱碱盐,水解显酸性,水解的离子方程式为Ag+ + H2O 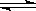 AgOH + H+由于水解会生成杂质,所以加入硝酸来抑制水解。(2)铝离子水解的离子方程式为:Al3+ +3H2O
AgOH + H+由于水解会生成杂质,所以加入硝酸来抑制水解。(2)铝离子水解的离子方程式为:Al3+ +3H2O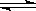 Al(OH)3 +3H+(3)纯碱是碳酸钠,是强碱弱酸盐,水解溶液显碱性,碱性条件下油污会发生水解而被除去,CO32-水解的离子方程式为:CO32- + H2O
Al(OH)3 +3H+(3)纯碱是碳酸钠,是强碱弱酸盐,水解溶液显碱性,碱性条件下油污会发生水解而被除去,CO32-水解的离子方程式为:CO32- + H2O 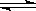 HCO3- +OH-
HCO3- +OH-
考点:盐类水解的应用和离子方程式的书写。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《原电池原理.. | |