微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s)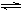 NH3(g) + HI(g)? b.2HI(g)
NH3(g) + HI(g)? b.2HI(g) 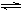 ?H2(g) + I2(g)
?H2(g) + I2(g)
①写出反应a的平衡常数表达式?
②达到平衡后,扩大容器体积,反应b的移动方向?(填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化?(填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g) 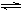 2NH3(g) ?ΔH=-92.60 kJ·mol-1
2NH3(g) ?ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
?时间(h)
物质的量(mol)
| 0
| 1
| 2
| 3
| 4
|
N2
| 1.50
| n1
| 1.20
| n3
| 1.00
|
H2
| 4.50
| 4.20
| 3.60
| n4
| 3.00
|
NH3
| 0
| 0.20
| ?
| 1.00
| 1.00
|
?
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱在溶液中分步电离,请用离子反应方程式表示其水溶液显碱性的原因?
参考答案:(1)① k=[NH3] [HI] ?② 正向?变浅(2) bd
(3)①27.78?②0.05 ③0.15?④正反应
(4)N2H4·2H2O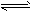 [N2H5·H2O]+?+ OH-
[N2H5·H2O]+?+ OH-
本题解析:(1)①根据题给反应a结合平衡常数表达式的书写原则写出,反应a的平衡常数表达式为k=[NH3] [HI];②反应a是反应前后气体体积增大的反应,反应b是反应前后气体体积不变,所以增大容器体积相当于压强减小,平衡向气体体积增大的方向移动,所以平衡向正反应方向移动,因为容器体积增大,平衡时I2(g)的浓度减小,气体颜色变浅;(2)a.单位时间内生成2nmolNH3的同时消耗3nmolH2,同时生成3n?molH2,该反应达到平衡状态,错误;b.当单位时间内生成6nmolN-H键同时消耗3nmolH-H键反应处于平衡状态,现同时生成2n?molH-H键,则平衡向在反应方向移动,正确;c.反应处于任何状态,用N2、H2、NH3的物质的量浓度变化表示的反应速率之比均等于化学计量数之比,为1:3:2,不能确定该反应向正反应方向移动,错误;d.混合气体的平均摩尔质量增大,则平衡向气体体积减小的正反应方向移动,正确;e.混合气体质量不变,容器体积不变,所以容器内的气体密度始终不变,错误;选:bd;(3)①根据题给数据分析,反应进行到2 h时生成氨气0.6mol,结合题给热化学方程式计算放出的热量为27.78 kJ;②根据题给数据分析,0~1 h内N2的物质的量变化为0.1mol,根据公式v=Δn/VΔt计算,平均反应速率为0.05 mol·L-1·h-1;③根据题给数据分析,反应达到平衡后c(NH3)=0.5mol/L,c(N2)=0.5mol/L,c(H2)=1.5mol/L,化学平衡常数K=[NH3]2/[N2][H2]3=0.15;④反应达到平衡后,再加入N2、H2和NH3各1.00 mol,c(NH3)=1mol/L,c(N2)=1mol/L,c(H2)=2mol/L,浓度商Q=0.125<K,则平衡向正反应方向移动;(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱N2H4?2H2O,电离方程式为:N2H4?2H2O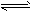 [N2H5?H2O]++OH-。
[N2H5?H2O]++OH-。
本题难度:一般
2、选择题 在一定温度下,下列叙述不是可逆反应 达到平衡的标志的是
达到平衡的标志的是
[? ]
(1)C的生成速率与C的分解速率相等;
(2)单位时间生成amol A,同时生成3amol B;
(3)A、B、C的浓度不再变化;
(4)A、B、C的压强不再变化;
(5)混合气体的总压强不再变化;
(6)混合气体的物质的量不再变化;
(7)单位时间消耗amol A,同时生成3amol B;
(8)A、B、C的分子数目比为1:3:2。
A.(2)(8)
B.(7)(4)
C.(1)(3)
D.(5)(6)
参考答案:A
本题解析:
本题难度:一般
3、实验题 (7分)下表数据是在某高温下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录。
反应时间t/h
| 1
| 4
| 9
| 16
| 25
|
MgO层厚y/nm
| 0.05a
| 0.20a
| 0.45a
| 0.18a
| 1.25a
|
NiO层厚y′/nm
| B
| 2b
| 3b
| 4b
| 5b
|
注:a和b均为与温度有关的常数。
(1)金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是_______________
_______________________________________________________________________________;
(2)金属氧化膜厚y跟时间t所呈现的关系是(填“直线”、“抛物线”、“对数”或“双曲线”等类型):MgO氧化膜的膜厚y与时间t的关系属________型;NiC氧化膜的膜厚y′与时间t的关系属________型;
(3)Mg与Ni比较,哪一种金属具有更良好的耐氧化腐蚀性?阐述其理由。
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
_______________________________________________________________________________。
参考答案:(1)反应速率可用反应物的消耗速率表示,也可用产物的生成速率来表示
(2)直线?抛物线
(3)Ni?它的腐蚀速率随时间的增长比镁的要慢
本题解析:由表中所列数据及题干中的提示(直线、抛物线、对数或双曲线等类型)不难导出以下关系式:y=0.05at;y′=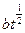 ,由此可得出结论:MgO膜厚y与时间t的关系为直线型;NiO膜厚y′与时间t的关系为抛物线型。由以上所得两个关系式可知,y′随时间t增长要比y随时间t增长得慢,所以镍的耐高温腐蚀性要比镁的好。
,由此可得出结论:MgO膜厚y与时间t的关系为直线型;NiO膜厚y′与时间t的关系为抛物线型。由以上所得两个关系式可知,y′随时间t增长要比y随时间t增长得慢,所以镍的耐高温腐蚀性要比镁的好。
本题难度:简单
4、选择题 向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O (g) CO2 +H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
CO2 +H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
A.0.5molCO+2molH2O(g)+1molCO2+1molH2
B.1molCO+1molH2O(g)+1molCO2+1molH2
C.0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
D.0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2
参考答案:B
本题解析:先用极值法,将CO2,H2全部转化为CO,H2O
A、 CO+H2O(g)  CO2+H2
CO2+H2
n起? 0.5? 2? 1? 1
n变? 1? 1? 1? 1
n终? 1.5? 3? 0? 0
所以相当于加入了1.5mol CO,和加入3molH2O,?增大了相同倍数,所以平衡不移动,CO的体积分数不变
B 、CO+H2O(g)  CO2+H2
CO2+H2
n起? 1? 1? 1? 1
n变? 1? 1? 1? 1
n终? 2? 2? 0? 0
所以相当于加入了2mol CO,和加入2molH2O ,?相当增大了CO的浓度,所以平衡正向移动,所以CO的转化率增大了,但转化的CO的量少过加入CO的量所以,CO的体积分数大于x
C 、CO+H2O(g)  CO2+H2
CO2+H2
n起? 0.5? 1.5? 0.4? 0.4
n变? 0.4? 0.4? 0.4? 0.4
n终? 0.9? 1.9? 0? 0
所以相当于加入了0.9mol CO,和加入1.9molH2O ,?相当增大了H2O的浓度所以平衡正向移动,所以CO的转化率增大了,CO的体积分数小于x
D 、CO+H2O(g)  CO2+H2
CO2+H2
n起? 0.5? 1.5? 0.5? 0.5
n变? 0.5? 0.5? 0.5? 0.5
n终? 1? 2? 0? 0
所以相当于加入了1mol CO,和加入2molH2O? ,所以CO的体积分数为x
点评:本题考查学生对化学平衡中等效平衡的理解以及对可逆反应的影响因素的熟悉掌握。
本题难度:简单
5、选择题 二甲醚是一种清洁燃料,以n(H2)/n(CO)=2通入1L的反应器中,一定条件下发生反应:2CO(g)+4H2(g)  CH3OCH3(g) +H2O(g) ?△H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
CH3OCH3(g) +H2O(g) ?△H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是

A.上述反应△H>0
B.图中P1<P2<P3
C.若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时v(正)<v(逆)
D.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
参考答案:C
本题解析:A、从图像看,反应温度越高,CO的转化率越小,说明正反应为放热反应,错误;B、该反应为体积减小的反应,压强越大,平衡正向移动,CO的转化率大,在图中作一等温线可知,P1对应的转化率大,则P1的压强大,错误;C、在P3和316℃时,CO的转化率为50%,设起始时,n(H2)=2a,n(CO)=a,平衡时,n(H2)=a,n(CH3OCH3)=0.25a,若n(H2)= n(CH3OCH3),则产物的量变多,故平衡需逆向移动,即逆反应速率大于正反应,正确;D、题中图表示的是n(H2)/n(CO)=2,若n(H2)/n(CO)=3,即H2的量增多,所以CO的转化率比原平衡时大,错误。
本题难度:一般