微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:H(g) + H(g) = H2(g)? ΔH=-435.7kJ/mol,此热化学方程式包含的意义是
A.氢原子的能量比氢分子的能量低
B.两个氢原子结合成一个氢分子时放出435.7kJ能量
C.1mol氢分子分解成2mol氢原子要吸收435.7kJ能量
D.2mol氢原子结合1mol氢分子成要吸收435.7kJ能量
2、选择题 下列与化学反应原理相关的叙述不正确的是( )
A.放热反应中生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.盖斯定律实质上是能量守恒定律的体现
D.电离平衡、水解平衡和沉淀溶解平衡均为动态平衡
3、选择题 下列说法中正确的是( )
A.由H原子形成1molH-H键要吸收热量
B.所有燃烧反应都是放热反应
C.在稀溶液中,1mol酸与1mol碱发生中和反应生成水时所释放的热量称为中和热
D.凡经加热而发生的化学反应都是吸热反应
4、简答题 (16分)最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是?
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
离子
| K+
| Na+
| NH4+
| SO42-
| NO3-
| Cl-
|
浓度/ mol/L
| 4×10-6
| 6×10-6
| 2×10-5
| 4×10-5
| 3×10-5
| 2×10-5
|
根据表中的数据判断该试样的酸碱性为?,其pH=?。
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式?。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)  2NO(g) △H=+180.5kJ·mol-1?
2NO(g) △H=+180.5kJ·mol-1?
ⅱ? 2C(s)+ O2(g) 2CO(g)?△H ="-" 221.0 kJ·mol-1
2CO(g)?△H ="-" 221.0 kJ·mol-1
ⅲ?C(s)+ O2(g) CO2( g) △H ="-" 393.5 kJ·mol-1
CO2( g) △H ="-" 393.5 kJ·mol-1
温度升高,反应ⅲ化学平衡常数?。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式?。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等
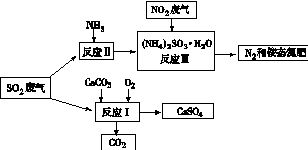
①写出反应Ⅰ的化学方程式:?。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是?。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是?。
5、填空题 (10分)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法Ⅰ
| 用炭粉在高温条件下还原CuO
|
方法Ⅱ
| 电解法,反应为2Cu + H2O 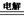 ?Cu2O + H2↑。 ?Cu2O + H2↑。
|
方法Ⅲ
| 用肼(N2H4)还原新制Cu(OH)2
|
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是? ▲?。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s)? △H = -169kJ·mol-1
C(s)+1/2O2(g)="CO(g)?" △H = -110.5kJ·mol-1
Cu(s)+1/2O2(g)="CuO(s)?" △H = -157kJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =? ▲ ?kJ·mol-1。
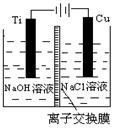
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为?▲?。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放 出N2。该制法的化学方程式为? ▲?。
出N2。该制法的化学方程式为? ▲?。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: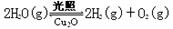 △H>0,水蒸气的浓度随时间t变化如下表所示。
△H>0,水蒸气的浓度随时间t变化如下表所示。

下列叙述正确的是? ▲?(填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率v(H2)=7×10-5 mol·L-1 min—1 ?
C.实验②比实验①所用的催化剂催化效率高