?
参考答案:(1)a、c。
(2)33.3%
(3)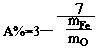

(4)当混合物是Fe2O3、Fe3O4时,8<a< 9
当混合物是Fe3 O4、FeO时6<a< 8 O4、FeO时6<a< 8
当混合物是Fe 2O3、Fe3O4、FeO时6<a<9 。 2O3、Fe3O4、FeO时6<a<9 。
本题解析:略
本题难度:简单
2、选择题 将质量为m g的铁粉与铜粉的混合物,溶于100mL 4mol·L-1 HNO3溶液(过量),充分反应后所得还原产物为0.05mol NO,再向所得溶液中加入足量的NaOH溶液至沉淀完全,则沉淀质量为
A.5.52g
B.(m+6.8)g
C.(m+2.55)g
D.(m+12.0)g
参考答案:C
本题解析:所得还原产物为0.05mol NO,所以转移的电子数就是0.15mol,铁粉与铜粉共失去0.15mol电子,带0.15mol的正电荷,所以要结合0.15mol氢氧根离子,沉淀质量为铁粉与铜粉的质量mg+0.15mol氢氧根离子,即为(m+2.55)g,故选C。
本题难度:简单
3、计算题 在某硫酸铜溶液中,加入一个质量为1.12g的铁片,经过一段时间,铁片表面覆盖了一层红色的铜,取出洗净、烘干,称重,质量变为1.16g。计算在这个化学反应中溶解了铁多少克?
参考答案:0.28g
本题解析:Fe+CuSO4=FeSO4+Cu,从化学方程可以看出,铁片质量的增加,与铁的溶解和铜的析出直接联系,每溶解56g铁,将析出64g铜,会使铁片质量增加:64g-56g=8g
根据铁片增加的质量(1.16g-1.12g),可计算出溶解的Fe的质量和析出的Cu的质量。
解:设溶解的Fe为xg,析出的Cu为yg
Fe+CuSO4=Cu+FeSO4?△m
56?64?64-56
x?y?1.16-1.12
则: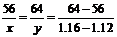 ,解得:x=0.28g? y=0.32g ,解得:x=0.28g? y=0.32g
答:在这个化学反应中溶解了铁0.28g。
本题难度:一般
4、简答题 用含少量铁的氧化物的氧化铜制取氯化铜晶体CuCl2xH2O.有如图1操作:

已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解.
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+.检验溶液A中Fe2+的最佳试剂为______(填编号,下同).
①KMnO4?②(NH4)2S?③NaOH?④KSCN
(2)氧化剂可选用______.
①Cl2?②KMnO4?③HNO3?④H2O2
(3)要得到较纯的产品,试剂可选用______.
①NaOH?②FeO?③CuO?④Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是______(按实验先后顺序选填编号).
①过滤?②蒸发浓缩?③蒸发至干?④冷却
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mol,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需______,如图2滴定方式中,最合理的是______(夹持部分略去)(填字母序号).
(6)为了测定制得的氯化铜晶体中CuCl2xH2O中x的值,某兴趣小组设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1g.
方案二:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为n2g.?试评价上述两种实验方案:其中正确的方案是______,据此计算得x=______(用含m、n1或n2的代数式表示).
参考答案:(1)亚铁离子具有还原性,能被高锰酸钾氧化为三价铁,使高锰酸钾褪色,是检验溶液A中Fe2+的最佳试剂,故答案为:①;
(2)根据题意,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以X为H2O2,或是Cl2,故答案为:①④;
(3)得到较纯的产品,试剂可选用CuO或Cu2(OH)2CO3,①②均会引入杂质离子,故答案为:③④;
(4)从滤液经过结晶得到氯化铜晶体,首先要加热蒸发浓缩,冷却后,再将之过滤即可,故答案为:②④①;
(5)配制一定物质的量浓度的KMnO4溶液需要的仪器有:天平、玻璃棒、烧杯、胶头滴管、250mL容量瓶,高锰酸钾具有强氧化性,必须放在酸式滴定管中,故答案为:250mL容量瓶;b;
(6)CuCl2?xH2O中x的值的确定依据是加热前后的质量差即为减少的水的质量,所以选择方案二,根据Cu元素守恒,则
CuCl2?xH2O~Cu(OH)2~CuO,
?1? 1
m135+18x? n280
即?m135+18x=n280
解得x=80m-135n218n2.
故答案为:二;80m-135n218n2.
本题解析:
本题难度:一般
5、实验题 某学习小组拟通过实验探究绿矾(FeSO4·7H2O)热分解的产物。
【实验前准备】
(1)理论分析?小组成员从理论上分析,认为下列分解产物不可能的是?。
a.Fe2O3、SO3、H2O?b.Fe2O3、SO2、SO3、H2O
c.FeO、Fe2O3、SO2、SO3、H2O
(2)查阅资料?常压下SO3熔点16.8℃,沸点44.6℃
【实验探究】
针对以上可能的组合猜想,该学习小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
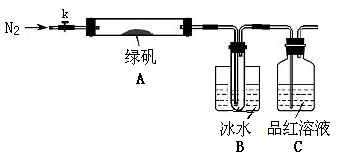
(3)实验过程
①仪器连接后,检查装置A与B气密性的操作为?。
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热
双通管。
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色。
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取
少量滴入几滴KSCN溶液,溶液变红色。
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
( 4)实验结果分析
结论1:B中收集到的液体是?。
结论2:C中溶液褪色,可推知产物中有?。
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足:?。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,
选用一种试剂鉴别,该试剂最合适的是?。
a.氯水和KSCN溶液? b.酸性KMnO4溶液? c. H2O2? d. NaOH溶液
参考答案:(1) a?(2分)
(3)①关闭K,向C中加水至浸没导管口,微热双通管,观察到C中导管口有气泡连续放出,表明AB装置气密性良好。
(4)H2SO4溶液?(2分)?SO2?(1分)
(5)在C装置后增加一套尾气处理装置?(2分)
(6)b?(2分)
本题解析:(1)加热FeSO4·7H2O发生氧化还原反应,氧化剂中有元素化合价降低,还原剂中有元素化合价升高,b、c项都有元素化合价的升高和降低,a中只有Fe元素化合价的升高,没有化合价的降低,故a项不可能。
(3)①利用加热时,气体体积膨胀检验装置的气密性,所以检查装置A与B气密性的操作为:关闭K,向C中加水至浸没导管口,微热双通管,观察到C中导管口有气泡连续放出,表明AB装置气密性良好。
(4)往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊,说明B中收集到的液体是H2SO4溶液;C中溶液时品红溶液褪色,说明加热FeSO4·7H2O有SO2产生。
(5)加热FeSO4·7H2O产生有毒的SO2,该装置没有尾气处理装置,所以应在C装置后增加一套尾气处理装置。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,Fe2+能使酸性KMnO4溶液褪色,所以最合适的为b项。
本题难度:一般
|