微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 甲、乙两同学欲制取纯净的Fe(OH)2 ,根据如图所示的装置进行试验。A管中是Fe+H2SO4, B管中是NaOH溶液,请回答下列问题。
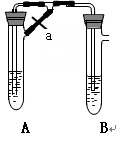
(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是?。
(2)同学乙:打开a,使A管中反应一段时间再?夹紧止水夹a,实验中在B管中观察到的现象是?,B中发生反应的离子方程式为?
(3)同学乙打开a的目的?;?(填甲或乙)同学可成功。
2、实验题 某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应。已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1

请回答:
(1)装置A中反应的化学方程式是______________________________;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是_______________________________;
(3)装置B中产生了白色沉淀,其成分是________;
(4)分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+、酸性条件下NO3-都反应;
猜想2:SO2与Fe3+反应;
猜想3:在酸性条件下SO2与NO3-反应;
①按猜想2,装置B中反应的离子方程式是_________,证明该猜想正确应进一步确认生成了________;
②按猜想3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是________(填字母)。
a.0.1 mol·L-1稀硝酸
b.1.5 mol·L-1Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol·L-1盐酸等体积混合的溶液
3、选择题 下列溶液有时呈黄色,其中是由于久置时被空气中氧化而变色的是?
A.浓硝酸
B.硫酸亚铁
C.工业盐酸
D.稀溴水
4、填空题 将铁与氧化铁的混合物15g加入150mL稀硫酸中,在标准状况下生成1.68LH2,同时固体物质全部溶解,向溶液中加入KSCN溶液,未见颜色改变。为中和过量的硫酸且使铁全部转化为Fe(OH)2,共消耗3mol/LNaOH溶液200mL,则原硫酸溶液物质的量浓度为? (? )
A.2mol/L
B.1.8mol/L
C.4mol/L
D.2.2mol/L
5、简答题 (14分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。

(1)B中反应的离子方程式是____。
(2)A中溶液变红的原因是____。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在?。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象Ⅱ的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为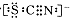
①甲同学认为SCN—中碳元素没有被氧化,理由是?。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是?。
③通过实验证明了SCN—中氮元素转化为NO3-,他的实验方案是____。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是?mol。
[-p age-]
1、实验题 甲、乙两同学欲制取纯净的Fe(OH)2 ,根据如图所示的装置进行试验。A管中是Fe+H2SO4, B管中是NaOH溶液,请回答下列问题。

(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是?。
(2)同学乙:打开a,使A管中反应一段时间再?夹紧止水夹a,实验中在B管中观察到的现象是?,B中发生反应的离子方程式为?
(3)同学乙打开a的目的?;?(填甲或乙)同学可成功。
参考答案:(1)在B管中观察到的现象是:生成灰白色沉淀迅速变成灰绿色,最后变成红褐色。
(2)有白色沉淀生成? Fe2++2OH-=Fe(OH)2?
(3)使A管中产生的气体通入B管中赶走空气?;乙
本题解析:由于Fe(OH)2 易被空气中的氧气气氧化,所以制备它关键是隔绝氧气。
(1)先夹紧止水夹a,使A管开始反应,产生的氢气将反应液(FeCl2)压入试管B,FeCl2与NaOH溶液反应得到Fe(OH)2白色沉淀,但系统中氧气的存在会将其氧化,生成灰白色沉淀迅速变成灰绿色,最后变成红褐色
(2)打开a,使A管中反应一段时间,产生的氢气密度小,会进入试管B中,将系统中的氧气排出,再夹紧止水夹a,产生的氢气将反应液(FeCl2)压入试管B,FeCl2与NaOH溶液反应得到Fe(OH)2白色沉淀,并且可稳定存在。
(3)很明显,乙同学的制法可成功达到实验目的。
本题难度:简单
2、实验题 某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应。已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1

请回答:
(1)装置A中反应的化学方程式是______________________________;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是_______________________________;
(3)装置B中产生了白色沉淀,其成分是________;
(4)分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+、酸性条件下NO3-都反应;
猜想2:SO2与Fe3+反应;
猜想3:在酸性条件下SO2与NO3-反应;
①按猜想2,装置B中反应的离子方程式是_________,证明该猜想正确应进一步确认生成了________;
②按猜想3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是________(填字母)。
a.0.1 mol·L-1稀硝酸
b.1.5 mol·L-1Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol·L-1盐酸等体积混合的溶液
参考答案:(1)Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O (2)打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹 (3)BaSO4 (4) ①SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+(可分两步写SO2+2Fe3++2H2O=2Fe2++SO42-+4H+、SO42-+Ba2+=BaSO4↓) Fe2+ ②c
本题解析::(l)装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O,故答案为:Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O;(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,操作为打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹,故答案为:打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹;(3)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀,故答案为:BaS04;还原性;(4)假设一 两种离子都氧化二氧化硫,即SO2和Fe3+、酸性条件下NO3-都反应,故答案为:SO2和Fe3+、酸性条件下NO3-都反应;①按观点2,装置B中反应的离子方程式是SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+,可通过检验是否有Fe2+生成的方法判断,具体做法为取少量B中溶液于试管中,加入少量铁氰化钾[K3Fe(CN)6]溶液产生蓝色沉淀,则溶液中有Fe2+,观点2合理,故答案为:SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+;②按观点3,在酸性条件下SO2与NO3-反应,实验中c(NO3-)=3mol/L,则可用6.0mol?L-1NaNO3和0.2mol?L-1盐酸等体积混合的溶液代替,故选c.
本题难度:困难
3、选择题 下列溶液有时呈黄色,其中是由于久置时被空气中氧化而变色的是?
A.浓硝酸
B.硫酸亚铁
C.工业盐酸
D.稀溴水
参考答案:B
本题解析:题目中给出的选项均可呈黄色。但原因各异。浓HNO3是因其中含有HNO3分解产物的NO2,工业盐酸是因为合Fe3+,而溴水则是其本色。FeSO4的溶液应为浅绿色。但Fe2+易被空气中O2氧化成Fe3+,Fe3+的水溶液呈黄色。
本题难度:一般
4、填空题 将铁与氧化铁的混合物15g加入150mL稀硫酸中,在标准状况下生成1.68LH2,同时固体物质全部溶解,向溶液中加入KSCN溶液,未见颜色改变。为中和过量的硫酸且使铁全部转化为Fe(OH)2,共消耗3mol/LNaOH溶液200mL,则原硫酸溶液物质的量浓度为? (? )
A.2mol/L
B.1.8mol/L
C.4mol/L
D.2.2mol/L
参考答案:A
本题解析:求解对象的始态是H2SO4,终态是Na2SO4,而Na+全部来源于NaOH且所加入的NaOH中的钠最终全部转化为Na2SO4,依电荷守恒原理有3mol·L-1×0.2L×1=0.15L×c(H2SO4)×2,c(H2SO4)=2mol/L。
本题难度:简单
5、简答题 (14分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。

(1)B中反应的离子方程式是____。
(2)A中溶液变红的原因是____。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在?。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象Ⅱ的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为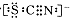
①甲同学认为SCN—中碳元素没有被氧化,理由是?。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是?。
③通过实验证明了SCN—中氮元素转化为NO3-,他的实验方案是____。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是?mol。
参考答案:(14分)
(1)Cl2+2 OH-= Cl-+ ClO-+ H2O;
(2)Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色Fe(SCN)3,所以溶液变红
(3)①Fe3+
(4)①SCN-中的碳元素是最高价态+4价
②硫元素
③取足量铜粉于试管中,加入A中黄色溶液和一定量的盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在NO3-,SCN-中氮元素被氧化成NO3-;
④16
本题解析:(1)B中是氯气与氢氧化钠的反应,离子方程式为Cl2+2 OH-= Cl-+ ClO-+ H2O;
(2)A中的Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色Fe(SCN)3,所以溶液变红
(3)①加入NaOH溶液,有红褐色沉淀生成,此红褐色沉淀为氢氧化铁沉淀,则溶液中一定存在Fe3+
(4)①因为SCN—中碳元素已经是最高价态+4价;
②与盐酸酸化的BaCl2溶液,产生白色沉淀,此白色沉淀为硫酸钡沉淀,所以被氧化的元素是硫元素;
③证明SCN—中氮元素转化为NO3-,利用硝酸的强氧化性,被还原的产物是红棕色气体,可证明SCN—中氮元素转化为NO3-,
④SCN—与Cl2反应生成1 mol CO2,说明有1mol的SCN—与Cl2反应,SCN—中的-2价S、-3价N化合价升高到+6价、+5价,失电子总数为8+8=16mol,所以转移电子的物质的量为16mol。2与FeCl2和KSCN混合溶液的反应实验,离子检验,根据元素价态判断发生的反应,电子转移数目的确定
本题难度:一般