微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知氯化铁溶液跟铜反应生成氯化铜和氯化亚铁。电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是?,证明Fe3+存在的现象是?。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式(1分):?
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
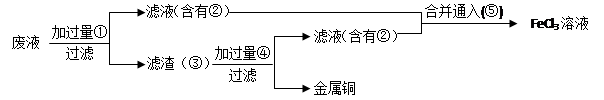
A.请写出上述实验中加入或生成的有关物质的化学式:
①?,②?,④?,
B.请写出含有②的滤液与⑤反应的离子方程式(1分):?
该反应中氧化剂为?还原剂为?。
参考答案:(9分)(1)KSCN;溶液呈红色 ;(2) 2Fe3++Cu=2Fe2++Cu2+
(3) A.①Fe ,②FeCl2,④HCl? B. 2Fe2+ + Cl2 ="=" 2Fe3+ + 2Cl-;Cl2;FeCl2
本题解析:(1)铁离子能和KSCN溶液发生显色反应,溶液显红色,所以检验溶液中Fe3+存在的试剂是能和KSCN溶液。
(2)氯化铁能和氧化金属铜,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+。
(3)要从废液中回收金属铜,则需要加入还原剂铁粉,即①是Fe。过滤后生成的滤液是氯化亚铁,即②是氯化亚铁。而滤渣中含有铜和剩余的铁,则需要加入稀盐酸溶解铁,即④是HCl。滤液中含有氯化亚铁,要转化为氯化铁,则需要通入氯气将氯化亚铁氧化生成氯化铁即可。
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,注重能力的培养。该类试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
2、简答题 现有含FeCl2杂质的氯化铜晶体(CuCl2?2H2O),为制取纯净的CuCl2?2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:

已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH如下表.
| ? | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时约pH
Fe3+
Fe2+
Cu2+
1.9
7.0
4.7
3.2
9.0
6.7
|
请回答下列问题:
(1)本实验最适合的氧化剂X是______(填序号).
A.K2Cr2O7?B.NaClO?C.H2O2?D.KMnO4
(2)加氧化剂的目的是______.
(3)物质Y是______(写化学式),加入Y的目的是______.
(4)除去Fe3+的有关离子方程式是______.
(5)加入物质Y后得到的沉淀是______(写化学式).如何洗涤该沉淀沉淀?______.
(6)最后能不能直接蒸发结晶得到CuCl2?2H2O晶体?______,应如何操作?______.
参考答案:(1)根据框图,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以X为H2O2,故答案为:C;
(2)Fe2+沉淀为氢氧化物时所需pH与Cu2+的沉淀的pH相同,也就是说,Fe2+沉淀的同时,Cu2+也会沉淀,无法将两者分离开,根据题干提供信息可知Fe3+沉淀所需的pH较小,所以应先将Fe2+氧化为Fe3+后再将其除去,故答案为:将Fe2+氧化为Fe3+,便于生成沉淀而与Cu2+分离;
(3)结合题示,调节pH3.2~4.7,使Fe3+全部沉淀,同样不引进新杂质,所以Y最好为CuO或Cu(OH)2或CuCO3,故答案为:CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3;调节溶液的pH至3.2~4.7;
(4)除去Fe3+的有关离子方程式Fe3++3H2O?Fe(OH)3+3H+,CuO+2H+═Cu2++H2O,故答案为:Fe3++3H2O?Fe(OH)3+3H+,CuO+2H+═Cu2++H2O[或Cu(OH)2+2H+═Cu2++2H2O等];
(5)溶液Ⅱ为三价铁离子,Y为Fe(OH)3;Fe(OH)3可用蒸馏水洗涤,故答案为:Fe(OH)3;加蒸馏水至刚好淹没沉淀,过滤,重复几次;
(6)CuCl2属于强酸弱碱盐,加热蒸发时促进其水解(HCl易挥发),所以应在HCl气氛中采用低温减压蒸发结晶的方法,以得到CuCl2?2H2O的晶体,故答案为:不能;应在HCl的气流中加热蒸发.
本题解析:
本题难度:一般
3、实验题 (16分)某课外活动小组欲利用下列装置(部分固定装置略)完成下列实验;
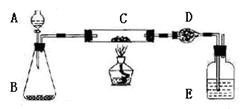
(一)实验目的:测定铜粉(含炭)样品中铜的质量分数
(二)实验用品:仪器:天平、分液漏斗、锥形瓶、硬玻璃管、干燥管、酒精灯、洗气瓶药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰。浓硫酸等
(三)实验内容:
在答题卡上按完成下表空白处内容
步骤
| 实验过程
| 实验现象
| 有关化学方程式
|
1
| ?
| 
| .com
|
2
| 在C中加入样品W克,D中装入碱石
灰后并称量为m1克。连接好仪器,打开A的活塞,慢慢加溶液。
| ?
| ?
|
3
| 对C进行加热。当C中药品充分反应后。关闭A的活塞。停止加热:
| ?
| ?
|
4
| 冷却后,称量D的质量为m2克。
| 
| 
|
?(四)计算:样品中铜的质量分数=______________(用含W、m1.m2的代数式表示)
(五)问题和讨论:
该小组重复测定了三次,得到铜的质量分数的数据存在较大的偏差,你认为原因可能是?。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置B中的产生的气体中的水蒸气通过C被D中碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
参考答案:(三)
步骤
实验过程
实验现象
有关化学方程式
1
按图连接好仪器后,
检查装置的气密性(3分)
-----------
----------
2
----------
B、E中有气泡产生(2分)
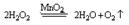
(1分)
3
----------
C中红色粉末变成黑色(2分)
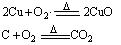
(各1分)
4
----------
----------
----------
本题解析:略
本题难度:简单
4、实验题 CuSO4?5H2O是铜的重要化合物,有着广泛的应用。CuSO4?5H2O的实验室制法如下:
Ⅰ.实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程(Fe3+在pH=5时已完全沉淀)
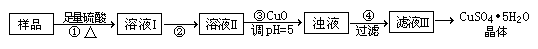 ?
?
回答下列问题:
⑴用98%的浓硫酸配制溶解所用的4.5 mol?L-1的稀硫酸,只需?种玻璃仪器
⑵步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是?
发生反应的离子方程式:?
⑶如何证明Fe2+已经充分转化??
⑷步骤④之后的实验操作是?,所需仪器是铁架台(带铁圈)、
?及抽滤装置。
Ⅱ.实验室用铜粉制备的CuSO4?5H2O流程图如下:
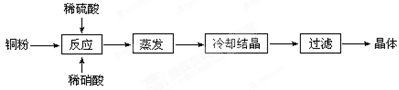
根据题意完成下列填空:
⑴理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为?,
发生反应的离子方程式为?。
⑵实际制得的胆矾晶体中还是含有一些杂质,通常采用?法提纯。
⑶实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是?
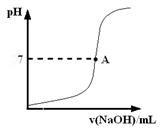
?。
请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。

⑷上述使用的标准氢氧化钠溶液已经通过基准物质的标定。下列物质中通常可用来标定碱液的基准物质是?。
A.醋酸
B.草酸
C.苯甲酸
D.苯酚
参考答案:Ⅰ.⑴5?⑵加入适量H2O2?2 Fe2++H2O2+2 H+=2 Fe3++2H2O
⑶取溶液Ⅱ少许,加入(H+)KMnO4溶液,若溶液不褪色,则Fe2+已充分转化
⑷蒸发浓缩,冷却结晶?蒸发皿、玻璃棒、酒精灯。
Ⅱ.⑴3∶2,3Cu+8 H++2NO3-=3Cu2++2NO↑+4H2O。?⑵重结晶
⑶加入最后一滴标准液,溶液变浅红色并在30s内不褪色。
 ?
?
⑷BC。
本题解析:Ⅰ.(1)需要的玻璃仪器水量筒、烧杯、玻璃棒、容量瓶、胶头滴管共计5种。
(2)要氧化亚铁离子,且不能引入新的杂质,应该选择双氧水,方程式为2 Fe2++H2O2+2 H+=2 Fe3++2H2O。
(3)因为亚铁离子具有还原性,能使酸性高锰酸钾溶液褪色,据此可以检验,即取溶液Ⅱ少许,加入(H+)KMnO4溶液,若溶液不褪色,则Fe2+已充分转化。
Ⅱ.(1)发生反应的离子方程式为3Cu+8 H++2NO3-=3Cu2++2NO↑+4H2O,所以消耗稀硫酸、稀硝酸溶质物质的量之比(8-2)÷2︰2=3︰2。
(2)要进一步提纯硫酸铜晶体,则需要重结晶。
(3)因为碱能使酚酞试液显红色,所以终点现象是加入最后一滴标准液,溶液变浅红色并在30s内不褪色。临近终点是pH会发生突变,图像为(见答案)。
(4)醋酸是弱酸,苯酚的酸性更弱,所以答案选BC。
本题难度:一般
5、填空题 某不锈钢(主要成分为Fe)样品中含有铝、铜、硅等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程:
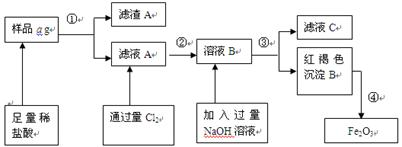
(1)取样品a g,称取时使用的主要仪器名称为_____?_______。
(2)滤液A中溶质主要含有_______??、__? __ _(写化学式);
操作①的名称?,其使用的玻璃仪器有______________________________。
(3)写出由溶液B生成红褐色沉淀B的离子方程式________________________________。
(4) 对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素的质量百分数的表达式为(用含a、b的式子表示)_____________。
(5)如何验证滤液A中含Fe2+,而不含Fe3+______________________?_____________。
参考答案:(1)托盘天平
(2) FeCl2、AlCl3 ; 过滤 ;?漏斗、烧杯、玻璃棒 。(错写不得分,漏写一个扣1分)
(3) Fe3+ + 3OH - ="=" Fe(OH)3↓
(4) (7b/10a)×100%? {或(70b/a)%}
(5)取少量滤液A于试管中,滴几滴KSCN溶液,溶液不变色,(2分)
再加氯水(或通氯气),溶液变为血红色。(1分)?(其他合理答案也可以)
本题解析:略
本题难度:一般