微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 .“北大富硒康”中含有微量元素硒(Se),对人体有保健作用。已知硒为第四周期ⅥA族元素,根据它在周期表中的位置推测,硒不可能具有的性质为(? )
A.硒化氢很稳定
B.硒化氢的水溶液显弱酸性
C.非金属性强于硫
D.最高价氧化物对应水化物酸性强于砷酸,弱于高溴酸
参考答案:AC
本题解析:首先确定Se在周期表中的位置, 根据同周期元素、同主族元素性质的递变规律可推知Se的非金属性强于As,弱于S、Br,进而可知D选项正确,C选项不正确。因Se的非金属性较弱,故H2Se不稳定。因氢硫酸显弱酸性,可推知氢硒酸也显弱酸性。
根据同周期元素、同主族元素性质的递变规律可推知Se的非金属性强于As,弱于S、Br,进而可知D选项正确,C选项不正确。因Se的非金属性较弱,故H2Se不稳定。因氢硫酸显弱酸性,可推知氢硒酸也显弱酸性。
本题难度:简单
2、选择题 关于下列图示的说法中正确的是
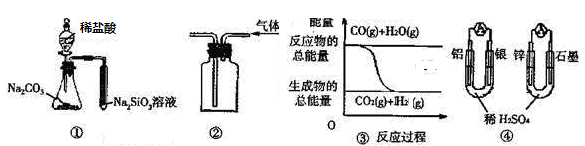
A.用图 ① 所示实验可比较氯、碳、硅三种元素的非金属性强弱
B.用图 ② 所示实验装置排空气法收集CO2气体

C.图 ③ 表示反应 CO(g)+H2O(g) CO2(g)+H2(g)是放热反应
D.图 ④ 两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
参考答案:C
本题解析:A、不能用盐酸,且盐酸易挥发,应用元素最高价氧化物的水化物比较酸性强弱,即此装置不能证明氯、碳、硅三种元素非金属性的强弱,故A错误;B、收集CO2应用向上排空气法,进气管应插入到集气瓶底部,故B错误;C、反应物总能量大于生成物总能量,应为放热反应,故C正确;D、两装置的负极反应分别为Al-3e-=Al3+、Zn-2e-=Zn2+,故通过导线的电子数相同时,消耗负极材料的物质的量不相同,D错误。
本题难度:简单
3、填空题 (18分)在元素周期表中有?个周期,?个族,其中有?个主族,周期序数等于原子的?,主族序数等于原子的?。同一周期从左到右,金属性逐渐?,非金属性逐渐?;同一主族从上到下,金属性逐渐?,非金属性逐渐?.(填“增强”或“减弱” )
参考答案:(每空2分)? 7?,? 16?,? 7?,电子层数?,最外层电子数?。?减弱?,?增强?;?增强?,?减弱?;
本题解析:横行叫周期竖行称作族,三短四长,七主七副一八又一零;同一周期从左到右,金属性逐渐减弱,非金属性逐渐增强。同一主族从上到下,金属性逐渐增强,非金属性逐渐减弱。
本题难度:一般
4、填空题 (7分)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的元素。
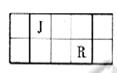
(1)元素T在周期表中的位置是位于①_________。
(2)J和氢组成的化合物A每个分子由4个原子组成且含有2个氢原子,其结构式为②________________,已知充分燃烧a gA物质时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则A物质燃烧热的热化学方程式是③__________。
(3)M和R形成的一种化合物能使酸性高锰酸钾溶液褪色,该反应的离子方程式为④______________。
(4)在微电子工业中,L的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为:⑤?。
(5)写出三种仅由上述五种元素中的一种或两种元素形成的漂白剂的化学式:⑥ __________________。
(6)其中L、M、R形成的氢化物沸点由高到低的顺序是⑦?(用化学式表示)
参考答案:(1)第三正确第ⅦA 族。?
(2) CH≡CH?;C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);?ΔH=-2b kJ / mol
(3)2MnO4ˉ? + 5SO2?+ 2H2O? =? 2Mn2+? +5SO42- +? 4H+ ?
(4)2NH3 ?+? 3H2O2 ?=? N2 +? 6H2O? _。
(5) O3、Cl2、SO2、ClO2?任写三个?
(6)? H2O> NH3> H2S
本题解析:考查元素周期表的结构及其应用。
地壳中含量最多的元素是氧,则M是氧。J元素最低负化合价的绝对值与其原子最外层电子数相等,则J是第ⅣA元素,根据J的物质可判断J是碳,则R是硫。由于原子序数依次增大,所以L是N,T是Cl。
(2)含有2个氢原子的有机物是乙炔,结构式为CH≡CH。燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,生成1mol二氧化碳气体,放出热量是b kJ,所以燃烧热多的热化学方程式为C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);?ΔH=-2b kJ / mol。
(3)能使酸性高锰酸钾溶液褪色,说明该化合物具有还原性,因此是SO2,方程式为2MnO4ˉ? + 5SO2?+ 2H2O? =? 2Mn2+? +5SO42- +? 4H+。
(4)氮的氢化物是氨气,具有还原性,被双氧水氧化生成氮气和水,方程式为2NH3 ?+? 3H2O2 ?=? N2 +? 6H2O。
(5)常见漂白剂有O3、Cl2、SO2、ClO2等。
(6)水和氨气中都存在氢键,但氧原子的非金属性强于氮原子的,所以形成的氢键要,常温下是液体,氨气是气体,所以沸点高低顺序为H2O> NH3> H2S。
本题难度:一般
5、填空题 A、B、C、D、E五种短周期元素,已知:
①原子半径递增顺序为:A、D、C、B、E
②短周期(除稀有气体元素外)所有元素中A的原子半径与E的原子半径之比为最小
③B、C、D三种元素电子层相同,三者原子序数之和为21,且D原子次外层电子数为最外层电子数的,
请回答下列问题:
(1)写出E单质在D单质中燃烧产物的电子式:?。(2)C2A4·H2O与NH3·H2O相似,水溶液也呈弱碱性,用电离方程式表示其水溶液呈弱碱性的原因:?。(3)B、D、E三种元素可组成常见化合物X,A、B、D、E可组成常见化合物Y,X、Y均是生活中常见的化学试剂,它们在一定条件下可互相转化。当a mol Y转化成amol X时:(溶液中进行)
①若加入a mol纯净物Z就可实现转化,则加入Z为?(填一种Z物质化学式)。②若加入0.5a mol纯净物Z就可实现转化,则加入Z为?(填一种Z物质化学式)。(4)C2A4可用作高能燃料电池的燃料,生成物之一为C的单质,惰性材料作电极,KOH作电解质溶液构成原电池,写出负极的电极反应:?;用该电池电解过量CuSO4溶液,共收集到3.36 L(标准状况)的气体,电池消耗6.4 g C2A4,则该燃料的利用率为?。
参考答案:(1)Na+[∶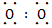 ∶]2-Na+
∶]2-Na+
(2)N2H4·H2O N2
N2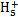 +OH-
+OH-
(3)①NaOH(或其他合理答案) ②Na2O(或其他合理答案)
(4) N2H4-4e-+4OH- N2+4H2O 75%
N2+4H2O 75%
本题解析:由②可知A是原子半径最小的H,E为短周期元素原子半径最大的Na,由③可知D为O,结合①可知B、C、D在元素周期表中的大致位置为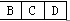 ;由原子序数之和为21可知B、C只能分别为碳、氮。(1)E与D点燃生成Na2O2,电子式为Na+[∶
;由原子序数之和为21可知B、C只能分别为碳、氮。(1)E与D点燃生成Na2O2,电子式为Na+[∶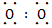 ∶]2-Na+;(2)结合NH3·H2O电离的方程式即可写出N2H4·H2O的电离方程式;(3)NaHCO3转化为Na2CO3应该加入碱,由a mol Y转化成a mol X可知①可能是NaOH或Na;②中1 mol物质溶于水生成2 mol NaOH,可以是Na2O或Na2O2;(4)燃料作负极失电子,N2H4失4个电子生成N2和H2O,碱性溶液中用OH-配平;电解池只生成O2,n(O2)="0.15" mol,转移电子0.6 mol;n(N2H4)="0.2" mol,转移电子0.8 mol,所以燃料利用率为
∶]2-Na+;(2)结合NH3·H2O电离的方程式即可写出N2H4·H2O的电离方程式;(3)NaHCO3转化为Na2CO3应该加入碱,由a mol Y转化成a mol X可知①可能是NaOH或Na;②中1 mol物质溶于水生成2 mol NaOH,可以是Na2O或Na2O2;(4)燃料作负极失电子,N2H4失4个电子生成N2和H2O,碱性溶液中用OH-配平;电解池只生成O2,n(O2)="0.15" mol,转移电子0.6 mol;n(N2H4)="0.2" mol,转移电子0.8 mol,所以燃料利用率为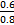 ×100%=75%。
×100%=75%。
本题难度:一般