微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (11分)在一定温度下将2 mol A和2 mol B两种气体混合于某2L密闭容器中,发生如下反应: 3A(g)+B(g)
3A(g)+B(g)  2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
(1)2min内B的反应速率为_________________
(2)此温度下该反应的平衡常数K=_________________________
(3)如果缩小反应容器的体积,使压强增大,平衡体系中C的物质的量浓度_____________,C的质量分数___________,容器内气体的平均密度________________,平均相对分子质量________________。(填“增大”、“减小”或“不变”)
(4)如果上述反应在相同条件下从逆反应开始进行,开始加C和D各4/3 mol,要使平衡时各物质的物质的量与原平衡相等,则还应加入__________物质___________mol。
参考答案:(11分)
(1)0.1moL/(L·min)?(2分)
(2)1/2?(2分)
(3)增大?不变?增大?不变?(各1分)
(4)B?(1分)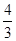 (2分)
(2分)
本题解析:(1)根据速率公式可计算出用D表示的反应速率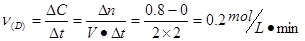 ,同一反应中,速率之比等于反应方程式的计量数之比,所以
,同一反应中,速率之比等于反应方程式的计量数之比,所以
(2)反应到达平衡时各物质的物质的量变化如下:

平衡时各物质的浓度分别为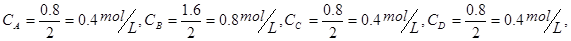
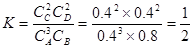
(3)若果缩小容器的体积,增大压强,根据反应前后气体体积不变,所以增大压强,平衡不发生移动,C的物质的量不变,体积变小,C的物质的量浓度增大;因为平衡不移动所以C得质量分数不变;气体的总质量不变,但是气体的体积减小,所以混合气体的平均密度增大;平均相对分子质量计算公式为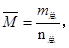 反应前后都是气体,根据质量守恒,总质量不变,反应前后体积没有发生变化,所以反应前后总的物质的量也不发生变化,根据公式可判断平局相对分子质量也不变。
反应前后都是气体,根据质量守恒,总质量不变,反应前后体积没有发生变化,所以反应前后总的物质的量也不发生变化,根据公式可判断平局相对分子质量也不变。
(4)要使与原平衡相同,即是达到等效平衡,若将4/3 mol的 C和D转化为反应物A和B,根据方程式可得到A为2mol与原平衡的投料相同, B为 mol,原平衡中B的量为2mol,要使原平衡相同必须再加入B物质2—
mol,原平衡中B的量为2mol,要使原平衡相同必须再加入B物质2— =
=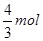 。
。
本题难度:一般
2、填空题 (10分)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示S形成硫酸酸雨的反应方程式 , 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是?。
(3)吸收液吸收SO2的过程中,pH随n(SO3?﹣),n(HSO3﹣)变化关系如下表:
n(SO3?﹣):,n(HSO3﹣)
| 91:9
| 1:1
| 1:91
|
PH
| 8.2
| 7.2
| 6.2
|
①上表判断NaHSO3溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
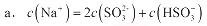

(4)当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:

①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用。简述再生原理:
。
参考答案:(1)SO2+H2O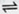 H2SO3? 2H2SO3+O2
H2SO3? 2H2SO3+O2 2H2SO4
2H2SO4
(2)2OH-+ SO2=H2O+SO32-?
(3)①酸性? HSO3-存在:HSO3-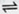 H++SO32-和HSO3-+H2O
H++SO32-和HSO3-+H2O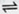 H2SO3+OH-,HSO3-的电离程度强于水解程度。? ②a b
H2SO3+OH-,HSO3-的电离程度强于水解程度。? ②a b
(4)①HSO3-+H2O-2e-= SO42-+3H+?
②H+在阴极得电子生成H2,溶液中c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液就可以再生。
本题解析:(1)SO2形成硫酸型酸雨时,二氧化硫和空气中的水、氧气反应得到硫酸:SO2+H2O H2SO3,2 H2SO3+O2
H2SO3,2 H2SO3+O2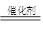 2H2SO4;
2H2SO4;
(2)二氧化硫被氢氧化钠溶液吸收制备亚硫酸钠溶液时:SO2+2OH- =SO32-+H2O;
(3)根据表中数据,可知,n(SO3?﹣):n(HSO3﹣)=1:91时,溶液的pH值为酸性,故NaHSO3溶液显酸性,在亚硫酸氢钠溶液中HSO3-存在:HSO3- SO32-+H+和HSO3-+H2O=H2SO3+OH-,HSO3-的电离程度强于水解程度,故溶液呈酸性。当吸收液呈中性时,溶液中的c(H+)=c(OH-),由于溶液中存在着电荷守恒,故c(Na+)+c(H+)=2c(SO32-)+ c(HSO3-)+c(OH-),可推出:c(Na+)=2c(SO32-)+c(HSO3-),a对;由于n(SO?﹣):n(HSO?﹣)=1:1时,溶液的pH值为7.2,故中性时一定有c(HSO3-)> c(SO32-),可推出:c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-),b对;
SO32-+H+和HSO3-+H2O=H2SO3+OH-,HSO3-的电离程度强于水解程度,故溶液呈酸性。当吸收液呈中性时,溶液中的c(H+)=c(OH-),由于溶液中存在着电荷守恒,故c(Na+)+c(H+)=2c(SO32-)+ c(HSO3-)+c(OH-),可推出:c(Na+)=2c(SO32-)+c(HSO3-),a对;由于n(SO?﹣):n(HSO?﹣)=1:1时,溶液的pH值为7.2,故中性时一定有c(HSO3-)> c(SO32-),可推出:c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-),b对;
(4)根据电解槽所示的变化,可知HSO3-在阳极放电的电极反应式是:HSO3-+H2O-2e- =3H++SO42-;H+在阴极得电子生成H2,溶液中的c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生。
点评:本题综合性强,难度较大,主要考查学生分析解决问题的能力
本题难度:困难
3、选择题 在温度和压强不变时,1LNO2高温分解(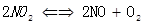 )达到平衡时体积变为1.3L,这时NO2的转化率为(?)
)达到平衡时体积变为1.3L,这时NO2的转化率为(?)
A.40%
B.20%
C.60%
D.5%
参考答案:C
本题解析:略
本题难度:一般
4、填空题 某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。
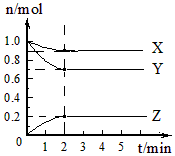
(1)反应开始至2mim,Y的平均反应速率_______________。
(2)分析有关数据,写出X、Y、Z的反应方程式______________________________。
参考答案:(1)0.03mol/(L·min)
(2)X(g)+3Y(g)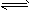 2Z(g)
2Z(g)
本题解析:
本题难度:一般
5、选择题 已知:CO(g) + H2O(g)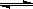 H2(g) + CO2(g)的平衡常数K随温度的变化如
H2(g) + CO2(g)的平衡常数K随温度的变化如
下表 ,下列说法正确的是
温度/℃
| 400
| 500
| 830
| 1000
|
平衡常数K
| 10
| 9
| 1
| 0.6
|
?
A.正反应是吸热反应
B.830℃时,反应达到平衡,[CO]=[CO2]
C.恒温时缩小容器体积使压强增大,正反应速率增大
D.400℃时,恒容反应器中投入CO、H?2O、H2、CO2物质的量分别为5 mol、1 mol、2 mol、3mol,反应向逆方向进行
参考答案:C
本题解析:A、温度升高,平衡常数减小,逆向移动,逆向吸热,正向放热;
B、达到平衡有[H2O][CO]=[H2][CO2];
C、压强增大,速率增大;
D、400℃,Q=1.2<K,故平衡正向移动
本题难度:一般